��Ŀ����
����Ŀ����1������ʦ�ڴ�ѧʱ����Cl2��NaOH��(NH2)2CO�����أ���SO2Ϊԭ���Ʊ�N2H4��H2O��ˮ���£�����ˮNa2SO3������Ҫʵ���������£�

��֪����Cl2+2OHClO+Cl+H2O�Ƿ��ȷ�Ӧ��
��N2H4��H2O�е�Լ118�棬����ǿ��ԭ�ԣ�����NaClO���ҷ�Ӧ����N2��
������Ʊ�NaClO��Һʱ�����¶ȳ���40�棬Cl2��NaOH��Һ��Ӧ����NaClO3��NaCl�������ӷ���ʽΪ_____��ʵ���п����¶ȳ��ñ�ˮԡ�⣬�����ȡ�Ĵ�ʩ��_______��
��2�������ϳ�N2H4��H2O��װ����ͼ��ʾ��

NaClO������Һ������ˮ��Һ��40�����·�Ӧһ��ʱ�����Ѹ��������110�������Ӧ��ʵ����ͨ����Һ©���μӵ���Һ��_________��ʹ�������ܵ�Ŀ����_____��
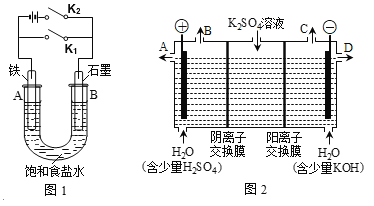
��3�������Ź���ʦ�������Ϸ���AgSCNΪ��ɫ�����Ag+��������SCN����Fe2+��Ϊ̽��SCN����Fe2+�Ļ�ԭ��ǿ������ͬѧ�������ͼʵ��װ�ò���������ʵ�顣

�ȶϿ����K������ҺX�еμ�0.1mol��L-1KSCN��Һ������������˵��___________________���պϵ��K�����۲쵽��ʵ����������ҺX��졢�ұ�ʯī�缫���й���������������ָ��ƫת���ݴ˵ó��Ľ�����_____����Һ����ԭ����__________________(�����ӷ���ʽ��ʾ)����ʵ����Ƶ��ŵ���_____��
���𰸡�3Cl2+6OH===5Cl+ClO3+3H2O ����ͨ��Cl2 NaClO������Һ ����ˮ���µĻӷ� ��Һ����Fe3+ Fe2+�Ļ�ԭ��ǿ��SCN- Fe2+-e-===Fe3+��Fe3++3SCN-===Fe(SCN)3 ���������Ӻͻ�ԭ�����Ӳ�ֱ�ӽӴ������������������������Ũ�Ƚ���
��������
��1���������Cl2��NaOH��Һ��Ӧ�Ʊ�NaClO��������еķ�ӦΪNaClO������Һ������ˮ��Һ��Ӧ�Ʊ�ˮ���£�������з����ˮ������Һ���������SO2��Na2CO3��Ӧ�Ʊ�Na2SO3��
��2��Ϊ�˷�ֹˮ���±�������Ӧ��εμ�NaClO������Һ��ʹ�������ܵ�Ŀ���Ǽ���ˮ���µĻӷ���
��3���ȶϿ����K������ҺX�еμ�0.1mol��L-1KSCN��Һ������������˵����Һ����Fe3+���պϵ��K�����۲쵽��ʵ����������ҺX��졢�ұ�ʯī�缫���й���������������ָ��ƫת���ݴ˵ó��Ľ�����Fe2+�Ļ�ԭ��ǿ��SCN-����Һ����ԭ����Fe2+-e-=Fe3+��Fe3++3SCN-=Fe(SCN)3����ʵ����Ƶ��ŵ��������ԡ���ԭ�����Ӳ�ֱ�ӽӴ������������������������Ũ�Ƚ��͡�
��1���¶ȳ���40�棬Cl2��NaOH��Һ�����绯��Ӧ����NaClO3��NaCl��H2O����Ӧ�Ļ�ѧ����ʽΪ��3Cl2+6NaOH=5NaCl+NaClO3+3H2O�����ӷ���ʽΪ��
3Cl2+6OH=5Cl+ClO3+3H2O������Cl2��NaOH��Һ�ķ�ӦΪ���ȷ�Ӧ��Ϊ�˼���NaClO3�����ɣ�Ӧ�����¶Ȳ�����40�棬������Ӧ���ʣ�ʵ���п����¶ȳ��ñ�ˮԡ�⣬�����ȡ�Ĵ�ʩ�ǻ���ͨ��Cl2���ʴ�Ϊ��3Cl2+6OH=5Cl+ClO3+3H2O������ͨ��Cl2��
��2��������еķ�ӦΪNaClO������Һ������ˮ��Һ��Ӧ�Ʊ�ˮ���£�����ˮ���¾���ǿ��ԭ�ԣ�����NaClO���ҷ�Ӧ����N2��Ϊ�˷�ֹˮ���±�������Ӧ��εμ�NaClO������Һ������ͨ����Һ©���μӵ���Һ��NaClO������Һ��NaClO������Һ������ˮ��Һ��110�������Ӧ��N2H4��H2O�е�Լ118�棬ʹ�������ܵ�Ŀ���Ǽ���ˮ���µĻӷ����ʴ�Ϊ��NaClO������Һ������ˮ���µĻӷ���
��3���ȶϿ����K������ҺX�еμ�0.1mol��L-1KSCN��Һ������������˵����Һ����Fe3+���պϵ��K�����۲쵽��ʵ����������ҺX��졢�ұ�ʯī�缫���й���������������ָ��ƫת���ݴ˵ó��Ľ�����Fe2+�Ļ�ԭ��ǿ��SCN-����Һ����ԭ����Fe2+-e-=Fe3+��Fe3++3SCN-=Fe(SCN)3����ʵ����Ƶ��ŵ������������Ӻͻ�ԭ�����Ӳ�ֱ�ӽӴ������������������������Ũ�Ƚ��ͣ��ʴ�Ϊ����Һ����Fe3+��Fe2+�Ļ�ԭ��ǿ��SCN-��Fe2+-e-=Fe3+��Fe3++3SCN-=Fe(SCN)3�����������Ӻͻ�ԭ�����Ӳ�ֱ�ӽӴ������������������������Ũ�Ƚ��͡�

 ��У����ϵ�д�
��У����ϵ�д�