��Ŀ����
����Ŀ����ҵ��������Ĺ�������ʾ��ͼ���£�
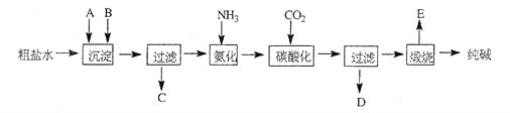
���������գ�
(1)����ˮ���������A��B������(������A��ʯ��Ҥ��)��д��A��B�Ļ�ѧʽ��A_______B_______
(2)ʵ�����ᴿ���ε�ʵ���������Ϊ��_______
(3)��ҵ��������������У�̼�ữʱ������������_______��̼�ữʱû������̼���ƾ��壬��ԭ����_______��
(4)̼�ữ����ˣ���ҺD����Ҫ�ijɷ���_______ (��д��ѧʽ)��������һ�ɷֵ������ӵľ��巽����_______����
(5)��������а���ѭ��ʹ�õģ�Ϊ�ˣ���ҺD����ʯ��ˮ����������ʯ��ˮ���������ķ�Ӧ�����ӷ���ʽΪ��_______����ҺD��ʯ��ˮǰ��Ҫ���ȣ�ԭ����_______��
(6)��Ʒ�����к���̼�����ơ�����ü��ȷֽ�ķ����ⶨ������̼�����Ƶ�����������������̼�����Ƶ����������ɱ�ʾΪ��_______ (ע����ı���ʽ�����õ��йط��ŵĺ���)
���𰸡�Ca(OH)2��CaO Na2CO3 �ܽ� ������ ������ ������ �о�������(����ֻ���) ̼�����ܽ�ȱ�̼�����ƴ� NH4Cl ȡ�����������ữ�������������а�ɫ���������������������� NH4++OH-![]() NH3��+H2O ��ֹ��ʯ��ˮʱ����̼��Ƴ���
NH3��+H2O ��ֹ��ʯ��ˮʱ����̼��Ƴ��� 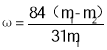
��������
����ˮ�к��и�þ���ӵ����ʣ��ɼ��������ơ�̼���Ƴ�ȥ�������CO32-�����������ȥ���ټ��백����������̼ʹ����ʳ��ˮ����̼�����ƹ��壬��������̼���ƺͶ�����̼���塣
(1)������AԴ��ʯ��Ҥ��˵��������ʯ�һ���ʯ�ң������е�þ���Ӻ�����һ����̼���Ƴ�ȥ�������CO32-�����������ȥ���ʴ�Ϊ��Ca(OH)2��CaO��Na2CO3��
(2)ʵ�����ᴿ���ε�������������Ϊ��ȡ�����ܽ⡢���������ˡ���������ȴ�ᾧ�����ˡ���ɼ������ʴ�Ϊ���ܽ⡢���ˡ����������ˣ�
(3)����������̼�ữʱ������̼���Ƶ��ܽ�ȴ���̼�����ƣ��۲쵽��Һ������NaHCO3���壬�ʴ�Ϊ���о�������(����ֻ���)��̼�����ܽ�ȱ�̼�����ƴ�
(4)���ݲ������̣�̼�ữ����Һ����Ҫ��NH4Cl���������е�������ʱ��ȡ�����������ữ�����������а�ɫ���������������������ӣ��ʴ�Ϊ��NH4Cl��ȡ�����������ữ�������������а�ɫ���������������������ӣ�
(5)��Һ����Ҫ���е����Ȼ�泥���ʯ��ˮ��Ӧʱ��NH4++OH-![]() NH3��+H2O��������Һ�л�����һ������̼�����ƣ���˼�ʯ��ˮǰ�ȼ��ȣ���Ϊ��ֹ��ʯ��ˮʱ����̼��Ƴ������ʴ�Ϊ��NH4++OH-
NH3��+H2O��������Һ�л�����һ������̼�����ƣ���˼�ʯ��ˮǰ�ȼ��ȣ���Ϊ��ֹ��ʯ��ˮʱ����̼��Ƴ������ʴ�Ϊ��NH4++OH-![]() NH3��+H2O����ֹ��ʯ��ˮʱ����̼��Ƴ�����
NH3��+H2O����ֹ��ʯ��ˮʱ����̼��Ƴ�����
(6)�������ǰ���������Ϊm1�����Ⱥ������Ϊm2��������ʧ������Ϊ��m1-m2������̼�����Ƶ�����Ϊ��84(m1-m2)/31���ʴ����к��е�̼�����Ƶ���������Ϊ��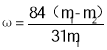 ��
��

����Ŀ����ϡ��ˮ�д�����������ƽ��NH3+H2O![]() NH3��H2O
NH3��H2O![]() NH4++OH�����ֱ���������������ʣ���Һ��c(OH��)��α仯��(��������������С������������)��ƽ���ƶ�������Σ�(�������������������������ƶ���)
NH4++OH�����ֱ���������������ʣ���Һ��c(OH��)��α仯��(��������������С������������)��ƽ���ƶ�������Σ�(�������������������������ƶ���)
��������� | ����(NH4)2SO4���� | ����HNO3��Һ | ����KOH��Һ |
c(OH-)�ı仯 | |||
ƽ���ƶ����� |


