题目内容
【题目】(1)某实验小组尝试用燃烧法确定有机物M的分子式,所用装置如下:


①产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是(以上装置不能重复使用):g→fe→hi→ __________ → ___________ →jk。
②F装置作用是________________。
③若准确称取有机物M(只含C、H、O三种元素中的两种或三种)3.24g,经充分燃烧后,A管质量增加9.24g,B管质量增加2.16 g,则该有机物的实验式为________。
④已知在相同条件下该M蒸气相对氢气的密度为54,且能与Na反应但不与NaOH溶液反应,写出该物质在灼热的铜丝条件下与氧气的反应方程式 _________________________________。
(2)在常温下测得的某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H原子给出的信号,其强度之比为2∶3,试确定该烃的结构简式为________;该烃在光照下生成的一氯代物在核磁共振谱中产生的吸收峰强度比为________。
【答案】cd(dc) ab(ba) 防止空气中水和二氧化碳进入装置,干扰实验结果 C7H8O 2![]() +O2
+O2 ![]() 2
2 ![]() +2H2O
+2H2O ![]() 2:2:2:3
2:2:2:3
【解析】
(1)①根据实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳、B用来吸收水、C用于干燥通入E中的氧气、D用来制取反应所需的氧气、E是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
②F装置作用是防止空气中水和二氧化碳进入装置,干扰实验结果;
③根据n=m/M计算水、二氧化碳的物质的量,根据质量守恒定律计算O元素质量,再根据原子守恒确定有机物的最简式;
④根据实验式确定该物质的分子式,还要知道该物质的相对分子质量,根据M=DM(H2)计算相对分子质量即可;且能与Na反应但不与NaOH溶液反应,该物质,不是酚,是苯甲醇,写出该物质在灼热的铜丝条件下与氧气的反应方程式。
(2)某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H原子给出的信号,其强度之比为2:3,则存在两种位置的H原子,且H原子数目之比为2:3,可知该烃为对二甲苯,该烃在光照下生成的一氯代物,其含有的H有4种;
(1)①D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选择装置各导管的连接顺序是g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a)→jk.
②F装置作用是防止空气中水和二氧化碳进入装置,干扰实验结果。
③水的物质的量=2.16g/18g·mol-1=0.12mol、二氧化碳的物质的量=9.24g/44g·mol-1=0.21mol,则m(C)+m(H)=0.21mol×12g+0.12mol×2×1g·mol-1=2.76g<3.24g,故有机物含有O元素,m(O)=3.24g-2.76g=0.48g,则n(O)=0.48g/16g·mol-1=0.03mol,n(C):n(H):n(O)=0.21:0.24:0.03=7:8:1,该有机物的实验式是C7H8O。
④确定该物质的分子式,还要知道该物质的相对分子质量,则M=DM(H2)=54×2g·mol-1=108g·mol-1,所以分子式为:C7H8O,且能与Na反应但不与NaOH溶液反应,该物质,不是酚,是苯甲醇,写出该物质在灼热的铜丝条件下与氧气的反应方程式, 2![]() +O2
+O2 ![]() 2
2 ![]() +2H2O ;
+2H2O ;
(2)某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H原子给出的信号,其强度之比为2:3,则存在两种位置的H原子,且H原子数目之比为2:3,数目分别为4、6,可知该烃为对二甲苯,其结构简式为![]() ,该烃在光照下生成的一氯代物,其含有的H有4种,如图
,该烃在光照下生成的一氯代物,其含有的H有4种,如图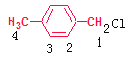 ,则在核磁共振谱中可产生4种信息,强度为3:2:2:2
,则在核磁共振谱中可产生4种信息,强度为3:2:2:2

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案