题目内容
一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:
2X(g)+Y(g) Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是
2X(g)+Y(g)
 Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是| A.将容器体积变为10L,Z的平衡浓度变为原来的二分之一 |
| B.以Y浓度变化表示的反应速率为0.0005mol /(L· s) |
| C.若增大压强,则物质Y的转化率减小 |
| D.若降低温度,X的体积分数增大,则该反应的△H<0 |
B
对于A选项,容器体积增大一倍,由2+1=3>1知,反应后气体量减少,根据勒夏特列原理,平衡向左移动,因此Z的平衡浓度小于原来的二分之一;B选项,Y浓度变化表示的反应速率为0.15mol/(5L*60s)=0.0005mol /(L· s),所以B选项正确;C选项,若增大压强,根据勒夏特列原理可知,平衡向降低压强的方向移动,即向右移动,则物质Y的转化率增大;D选项,若降低温度,X的体积分数增大,说明平衡向左移动,是放热过程,因此可以得知正反应是吸热的过程,△H>0

练习册系列答案
相关题目
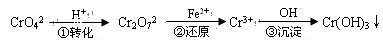
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O 2 Z(g),达到平衡时,若它们的物质的量满足:n(X)+n(Y)= n(Z),则Y的转化率为
2 Z(g),达到平衡时,若它们的物质的量满足:n(X)+n(Y)= n(Z),则Y的转化率为
 N2O4(g)。达平衡后,NO2的转化率为α1。再向容器中充入2 mol NO2,再次达到平衡,NO2的转化率为α2。再向容器中充入1 mol N2O4,再次达到平衡,NO2的转化率为α3 。则α1与α3的关系正确的是( )
N2O4(g)。达平衡后,NO2的转化率为α1。再向容器中充入2 mol NO2,再次达到平衡,NO2的转化率为α2。再向容器中充入1 mol N2O4,再次达到平衡,NO2的转化率为α3 。则α1与α3的关系正确的是( )
 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变 I3-(aq)。某I2、、KI混合溶液中,c(I3-)与温度(T)的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法中,正确的是
I3-(aq)。某I2、、KI混合溶液中,c(I3-)与温度(T)的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法中,正确的是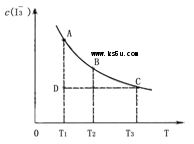
 I3-(aq)的△H>0
I3-(aq)的△H>0 PCl5(g),达平衡时,PCl5为0.40 mol,如果此时再加入1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g),达平衡时,PCl5为0.40 mol,如果此时再加入1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是 CO2(g)十H2 (g),△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率υ(CO)= mol/(L·min),此时该反应的平衡常数为 。
CO2(g)十H2 (g),△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率υ(CO)= mol/(L·min),此时该反应的平衡常数为 。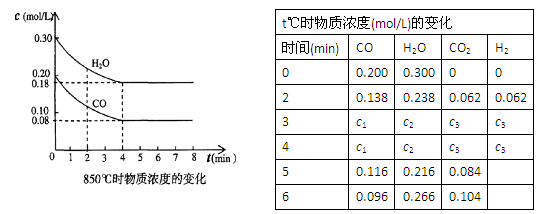
 状态;c1 0.08 (填 “>”、“<”或“=”)。
状态;c1 0.08 (填 “>”、“<”或“=”)。 Fe(s)+CO2(g) △H>0。
Fe(s)+CO2(g) △H>0。
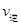 (填“<”、“>”或“=”),其原因是 。
(填“<”、“>”或“=”),其原因是 。