题目内容
在一定温度下,向VL密闭容器中充入2molNO2,发生如下反应:2NO2(g)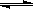 N2O4(g)。达平衡后,NO2的转化率为α1。再向容器中充入2 mol NO2,再次达到平衡,NO2的转化率为α2。再向容器中充入1 mol N2O4,再次达到平衡,NO2的转化率为α3 。则α1与α3的关系正确的是( )
N2O4(g)。达平衡后,NO2的转化率为α1。再向容器中充入2 mol NO2,再次达到平衡,NO2的转化率为α2。再向容器中充入1 mol N2O4,再次达到平衡,NO2的转化率为α3 。则α1与α3的关系正确的是( )
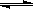 N2O4(g)。达平衡后,NO2的转化率为α1。再向容器中充入2 mol NO2,再次达到平衡,NO2的转化率为α2。再向容器中充入1 mol N2O4,再次达到平衡,NO2的转化率为α3 。则α1与α3的关系正确的是( )
N2O4(g)。达平衡后,NO2的转化率为α1。再向容器中充入2 mol NO2,再次达到平衡,NO2的转化率为α2。再向容器中充入1 mol N2O4,再次达到平衡,NO2的转化率为α3 。则α1与α3的关系正确的是( )| A.α1=α3 | B.α1>α3 |
| C.α1<α3 | D.无法确定 |
C
反应在一个体积不变的容器中发生,当第一次入2molNO2,达到平衡后,向容器中再加入2molNO2,该过程可以设计成两个等效过程,分别将2molNO2,投入一个两个体积都是VL的容器中让两个分别达到平衡,平衡后两个容器中NO2的转化率为α1,然后通过加压的方法将二者压缩在一个体积为VL的容器中,达到新的平衡,平衡后二氧化氮的转化率为α2,由于增大压强平衡向正向移动所以α1<α2,充入1 mol N2O4,相当于加入2mol二氧化氮,对于容器3中的反应可以类似上述过程,得出α2<α3,综上可以得出α1<α3,所以答案选C。

练习册系列答案
相关题目
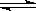 3Y(g)+Z(g)达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是
3Y(g)+Z(g)达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是 2H2+O2、2CO+O2
2H2+O2、2CO+O2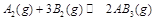 (正反应为放热反应),下列图像正确的是
(正反应为放热反应),下列图像正确的是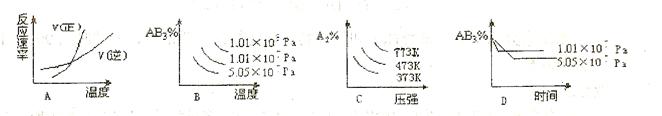
 Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是 N2O4达到平衡。(注意:视线b是一圆截面,颜色深浅可以看成有色分子在截面上的投影的密度大小)
N2O4达到平衡。(注意:视线b是一圆截面,颜色深浅可以看成有色分子在截面上的投影的密度大小)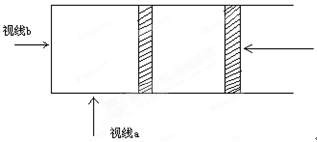
 2NH3,达到平衡后。则H2的转化率可能是
2NH3,达到平衡后。则H2的转化率可能是 2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。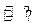 2HI(g),经充分反应达到平衡后,生成的HI(g)的气体体积的50%,在该温度下,在另一个容积为2L的密闭容器中充入1mol HI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)的气体体积的50%,在该温度下,在另一个容积为2L的密闭容器中充入1mol HI(g)发生反应HI(g)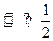 H2(g)+
H2(g)+ 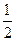 I2(g),则下列判断正确的是
I2(g),则下列判断正确的是