题目内容
(每空格3分,计18分)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为

其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的阳极反应式为:
。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) 。溶液中同时生成的沉淀还有 。
方法1:还原沉淀法
该法的工艺流程为

其中第①步存在平衡:2CrO42—(黄色)+2H+
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)
 Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的阳极反应式为:
。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) 。溶液中同时生成的沉淀还有 。
(每格3分计18分)(1)橙 (2)6 (3)5
(4) Fe-2e-=Fe2+
(5)2H++2e-=H2↑ Fe(OH)3
(4) Fe-2e-=Fe2+
(5)2H++2e-=H2↑ Fe(OH)3
分析:(1)根据外界条件对平衡的影响来考虑平衡移动方向,从而确定离子浓度大小,进而确定颜色变化;
(2)判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变,即能变的量保持不变则说明已达平衡;
(3)根据得失电子守恒来计算;
(4)根据溶度积常数进行计算;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子;
(6)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀.
解答:解:(1)c(H+)增大,平衡2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O右移,溶液呈橙色;
Cr2O72-(橙色)+H2O右移,溶液呈橙色;(2)平衡时各物质的浓度不再改变,即溶液的颜色不再改变;
(3)根据电子得失守恒可知,还原1molCr2O72-离子得到Cr3+,得电子:2×(6-3)═6mol,需要FeSO4?7H2O的物质的量为:6÷(3-2)═6;
(4)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=
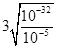 =10-9mol/L,c(H+)═
=10-9mol/L,c(H+)═
,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+;
(6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2的同时,大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀.
故答案为:(1)橙;(2)c;(3)6;(4)5;(5)阳极反应为Fe-2e-═Fe2+,提供还原剂Fe2+;(6)2H++2e-═H2↑;Fe(OH)3.
点评:本题综合考查了化学平衡原理、氧化还原反应、沉淀溶解平衡和电化学知识等内容.分析时要根据题给信息,结合相关原理进行解答.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 VO2++ 2H++V2+。
VO2++ 2H++V2+。 N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。

 2B(g)+C(g) △H>0,要使逆反应速率增大,A的浓度减小(只改变一个条件),应采取的措施是( )
2B(g)+C(g) △H>0,要使逆反应速率增大,A的浓度减小(只改变一个条件),应采取的措施是( ) Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是 2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。