题目内容
2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)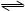 PCl5(g),达平衡时,PCl5为0.40 mol,如果此时再加入1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g),达平衡时,PCl5为0.40 mol,如果此时再加入1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
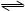 PCl5(g),达平衡时,PCl5为0.40 mol,如果此时再加入1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g),达平衡时,PCl5为0.40 mol,如果此时再加入1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是| A.0.60 mol | B.大于0.60 mol |
| C.1.50 mol | D.大于0.40 mol,小于0.60 mol |
B
考查化学平衡的移动及等效平衡
依据所给信息可知,当平衡时再加入1.0 mol PCl3和0.50 mol Cl2时,相当于另一个初始状态:3.0 mol PCl3和1.5 mol Cl2充入体积不变的密闭容器中;
我们可以这样理解:该初始状态的容器体积为1.5倍的原容器体积,那么平衡时,PCl5的物质的量一定为0.40×1.5="0.60" mol,再压缩至原容器体积,平衡正向移动,PCl5的物质的量增大,必定大于0.60 mol
依据所给信息可知,当平衡时再加入1.0 mol PCl3和0.50 mol Cl2时,相当于另一个初始状态:3.0 mol PCl3和1.5 mol Cl2充入体积不变的密闭容器中;
我们可以这样理解:该初始状态的容器体积为1.5倍的原容器体积,那么平衡时,PCl5的物质的量一定为0.40×1.5="0.60" mol,再压缩至原容器体积,平衡正向移动,PCl5的物质的量增大,必定大于0.60 mol

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
 Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.15molZ。下列说法正确的是

 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
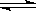 2NH3,达到平衡后。则H2的转化率可能是
2NH3,达到平衡后。则H2的转化率可能是 pC(g)+qD(g);△H<0;已知m+n>p+q.若反应由A与B组成的混合物开始,并分别在下列情况下达到平衡:在100℃,1×106Pa时,A的转化率为α1;在200℃,1×106Pa时,A的转化率为α2;在100℃,1×107Pa时,A的转化率为α3;则α1,α2,α3之间的大小关系是
pC(g)+qD(g);△H<0;已知m+n>p+q.若反应由A与B组成的混合物开始,并分别在下列情况下达到平衡:在100℃,1×106Pa时,A的转化率为α1;在200℃,1×106Pa时,A的转化率为α2;在100℃,1×107Pa时,A的转化率为α3;则α1,α2,α3之间的大小关系是 2NH3(g) △H<0,673K、30MPa下n(NH3)和n(H2)随时间变化的关系
2NH3(g) △H<0,673K、30MPa下n(NH3)和n(H2)随时间变化的关系 如下图所示。下列叙述不正确的是
如下图所示。下列叙述不正确的是
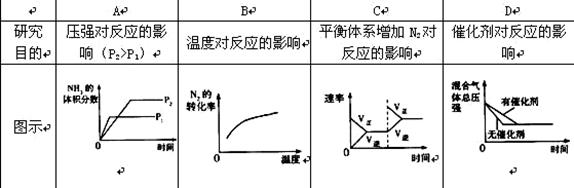
 2NH3(g) △H<0,下列探究目的和示意图相符的是
2NH3(g) △H<0,下列探究目的和示意图相符的是