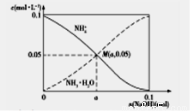
题目内容
11.下列有关制取溴苯的实验描述正确的是( )| A. | 在苯和液溴的混合物中,添加少量铁屑后马上剧烈反应 | |
| B. | 伸出烧瓶的导管要有足够长度,其作用是导出气体和充分冷凝回流逸出的苯和溴蒸气 | |
| C. | 导管末端应插入锥形瓶内水面以下,有利于HBr气体被吸收 | |
| D. | 反应后烧瓶中是褐色的油状液体,倒入盛有足量浓烧碱溶液的分液漏斗中,充分振荡后静置,上层液体是无色的溴苯 |
分析 A、苯与溴苯反应较慢,加入少量铁粉后,铁粉与溴生成溴化铁,溴化铁为此反应的催化剂,加快了化学反应速率,据此解答即可;
B、制取溴苯实验中长导管的作用是导气和冷凝回流;
C、HBr极易溶于水,此时应防止倒吸;
D、溴苯的密度大于水,下层液体是溴苯,据此解答即可.
解答 解:A、在苯和液溴的混合物中,添加少量铁屑后生成溴化铁催化剂,加快了化学反应速率,故A正确;
B、制取溴苯实验中长导管的作用是导气和冷凝回流,故B正确;
C、HBr极易溶于水,故导管末端不能插入锥形瓶内水面以下,故C错误;
D、反应后烧瓶中是褐色的油状液体是溶解有溴的溴苯,溴苯的密度大于水,且与水分层,故上层水水层,下层是溴苯,故D错误,
故选AB.
点评 本题主要考查的是实验室制取溴苯的实验,涉及催化剂的催化作用、导管的作用、分液原理等,难度一般,注意整理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.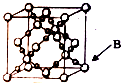 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E,所对应的元素符号作答)
(1)B、C、D第一电离能由大到小为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为sp2;1molA2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等;
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(6)BD2在高温高压下所形成晶体的晶胞如图所示,一个该晶胞中含16个D原子.
 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)B、C、D第一电离能由大到小为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为sp2;1molA2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等;
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(6)BD2在高温高压下所形成晶体的晶胞如图所示,一个该晶胞中含16个D原子.
19.日常生活中遇到的很多问题都涉及到化学知识,下列有关叙述正确的是( )
| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 我国自行研制的“神七”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | |
| C. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| D. | 食物溶于水后的溶液 pH<7,则该食物为成酸性食物 |
6.常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH随NaOH的滴入变化如图所示,下列说法不正确的是( )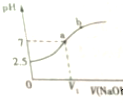

| A. | NaHSO3溶液呈酸性 | B. | V1<10mL | ||
| C. | 在a点,c(Na+)=c(SO32- )+c(HSO3-) | D. | 在b点,c(Na+)>c(SO3 2- ) |
16.如图中a、b、c、d为周期表前4周期的部分元素,下列叙述正确的是( )
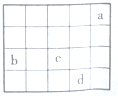

| A. | 四种元素中,d单质的化学性质最稳定 | |
| B. | 气态氢化物的还原性:d>c | |
| C. | 原子半径:b<c | |
| D. | b元素最高价氧化物可形成原子晶体 |
3.据报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是( )
| A. | O2(PtF6)晶体中含有离子键 | |
| B. | O2(PtF6)中氧元素的化合价为+1价 | |
| C. | 在此反应中,O2是氧化剂,PtF6是还原剂 | |
| D. | 反应中,每生成1mol O2(PtF6)转移1mol电子 |
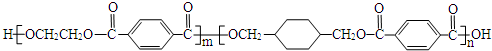
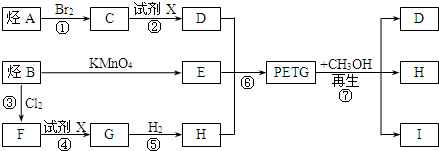
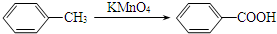
 .
.
 .
. .
.