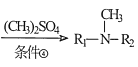
题目内容
【题目】由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下:
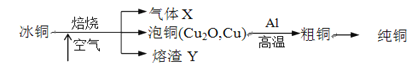
请回答下列问题:
(1)气体X是________。
(2)写出泡铜冶炼粗铜反应的化学方程式_______。
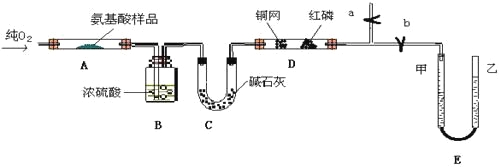
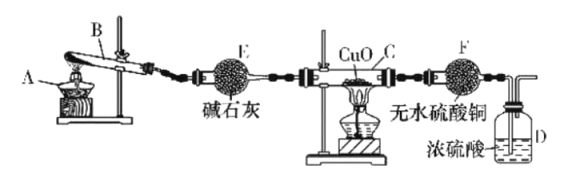
(3)某研究性学习小组用熔渣Y与CO反应来制取Fe(已略去加热装置)。
①请按气流由左到右的方向连接下列各装置,顺序为A→________→尾气处理装置;
②装置C的作用是________________。

(4)熔渣Y中铁元素的价态有+2价和+3价,为了测定熔渣中二价铁的含量。学习小组取23.2g熔渣用足量硫酸使其完全溶解,向反应后的溶液中加入酸性KMnO4溶液,一共消耗200mL0.1mol/L的KMnO4溶液。
①写出溶液中加入酸性高锰酸钾溶液后发生的离子方程式:________。
②熔渣中二价铁的质量分数为___%(保留三位有效数字)。
【答案】SO2 3Cu2O+2Al![]() 6Cu+ Al2O3 D→B→C 除去尾气中的CO2 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O 24.1
6Cu+ Al2O3 D→B→C 除去尾气中的CO2 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O 24.1
【解析】
冰铜焙烧得到二氧化硫、泡铜和铁的氧化物,泡铜通过铝热反应得到粗铜,粗铜经提纯可制得纯铜。
(1)FeS在空气中灼烧可生成二氧化硫;
(2)泡铜与铝发生铝热反应得粗铜;
(3)①用铁的氧化物与CO反应来制取Fe,应先将制得CO进行干燥再通与铁反应,反应后生成的二氧化碳用氢氧化钠溶液吸收,未反应的CO在空气中点燃,以免对空气产生污染;
②根据①的分析可析可知,便于CO点燃,用氢氧化钠除去尾气中的CO2;
(4)加入酸性高锰酸钾发生5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,结合高锰酸钾的物质的量可计算二价铁的质量分数。
:(1)冰铜含有S元素,在高温下可生成SO2,故答案为:SO2;
(2)泡铜与铝发生铝热反应得粗铜,反应的化学方程式为3Cu2O+2Al![]() 6Cu+Al2O3,
6Cu+Al2O3,
故答案为:3Cu2O+2Al![]() 6Cu+Al2O3;
6Cu+Al2O3;
(3)①用铁的氧化物与CO反应来制取Fe,应先将制得CO进行干燥再通与铁反应,反应后生成的二氧化碳用氢氧化钠溶液吸收,未反应的CO在空气中点燃,以免对空气产生污染,所以按气流由左到右的方向连接下列各装置,顺序为A→D→B→C,
故答案为:D→B→C;
②根据①的分析可析可知,便于CO能点燃,用氢氧化钠除去尾气中的CO2,所以装置C的作用是除去尾气中的CO2,
故答案为:除去尾气中的CO2;
(4)①亚铁离子具有还原性,与高锰酸钾发生氧化还原反应,离子方程式为5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,
故答案为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;
②n(KMnO4)=0.2L×0.1mol/L=0.02mol,由离子方程式可知n(Fe2+)=0.1mol,则23.2g熔渣中二价铁的质量分数为![]() ×100%=24.1%,故答案为:24.1。
×100%=24.1%,故答案为:24.1。

 53随堂测系列答案
53随堂测系列答案