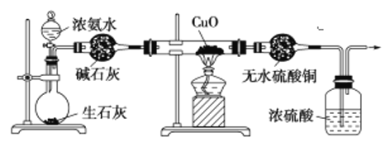
题目内容
【题目】平达喜是常用的中和胃酸的药物,它的化学成分是AlxMgy(OH)zCO3·nH2O,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当逐滴加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤、洗涤,沉淀物进行干燥后重1.74g。请计算该试样中:
(1)碳酸根的物质的量_____________;
(2)镁离子的物质的量_____________;
(3)通过计算确定该物质的化学组成为___________。
【答案】0.005mol 0.03mol Al2Mg6(OH)16CO3·4H2O
【解析】
⑴按照方程式HCO3- + H+ = H2O+ CO2↑计算生成二氧化碳消耗盐酸的物质的量,根据碳元素守恒得碳酸根的物质的量。
⑵生成氢氧化镁的沉淀质量为1.74g,计算氢氧化镁的物质的量,再根据守恒得镁离子的物质的量。
⑶先计算n(OH-),再根据n(OH-):n(CO32-):n(Mg2+)和根据电荷守恒求出n(OH-):n(CO32-):n(Mg2+):n(Al3+)的比例,根据碳酸根物质的量求摩尔质量求出n值。
⑴CO32- + 2H+ = H2O+ CO2↑生成二氧化碳消耗盐酸的物质的量为2.0mol/L × 0.0025L = 0.005mol;根据碳元素守恒得碳酸根的物质的量为0.005mol;故答案为:0.005mol。
⑵生成氢氧化镁的沉淀质量为1.74g,物质的量为![]() ,镁离子的物质的量为0.03mol;故答案为:0.03mol。
,镁离子的物质的量为0.03mol;故答案为:0.03mol。
⑶n(OH-) = 2.0mol/L× 0.0425L = 0.085mol,因此n(OH-):n(CO32-):n(Mg2+)=0.085mol:0.005mol:0.03mol = 16:6:1,AlxMg6(OH)16CO3·nH2O,再根据电荷守恒(+3)x+(+2)×6+(-1)×16+(-2)×1 = 0,得到x = 2,根据碳酸根物质的量求摩尔质量![]() ,27×2 + 24×6 + 17×16 + 48 + 18×n=602,n = 4;因此化学式为Al2Mg6(OH)16CO3·4H2O;故答案为Al2Mg6(OH)16CO3·4H2O。
,27×2 + 24×6 + 17×16 + 48 + 18×n=602,n = 4;因此化学式为Al2Mg6(OH)16CO3·4H2O;故答案为Al2Mg6(OH)16CO3·4H2O。

 53随堂测系列答案
53随堂测系列答案【题目】I.(1)下列右侧对左侧物质的描述与左侧任何物质都不对应的是_________(填右侧小写的编号);
物质 描述
A.四氧化三铁 a.自来水消毒剂
B.过氧化钠 b.工业制玻璃
C.碳酸氢钠 c.红色油漆和涂料
D.硅酸钠 d.木材防火剂
E.明矾 e.呼吸面具中氧气的来源
F.青铜 f.制光纤的材料
G.硅 g.用量最大的金属材料
H.氯气 h.焰色反应为绿色
II.(2)明矾溶液中加少量Ba(OH)2溶液的离子方程式 ______________;
(3)漂白粉溶液中通过量CO2的离子方程式________________;
(4)将KFe2Si3O8(OH)2改写为氧化物的形式________________,1mol KFe2Si3O8(OH)2和足量稀盐酸反应,消耗HCl的物质的量为________mol;
(5)配平下面的离子方程式,并用双线桥表示反应的电子转移:______
SO32- + MnO4- + — SO42-+ Mn2+ +______
III.(6)若要除去下列物质中的杂质(括号内为杂质),请将选用的试剂填入表格。
物质(杂质) | 试剂 |
NaHCO3溶液(Na2CO3) | ①______ |
FeCl3溶液(FeCl2) | ②______ |
SiO2(CaCO3) | ③______ |
Fe2O3(SiO2) | ④______ |