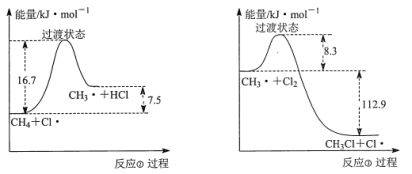
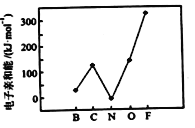
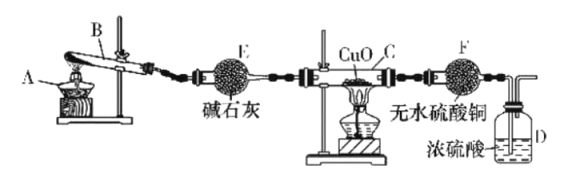
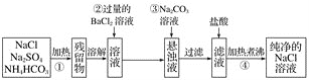
题目内容
【题目】下列叙述中,错误的是( )
A.摩尔是物质的量的单位
B.36g水中含氢原子数目为4NA(NA表示阿伏加德罗常数的值)
C.在0.5molNa2SO4中,含有的Na+数约是6.02×1023
D.等质量的O2与O3,所含氧原子数之比为3:2
【答案】D
【解析】
A. 物质的量是基本物理量,摩尔是物质的量的单位,故A正确;
B. 36g水的物质的量是![]() ,含氢原子数目2mol×2×NA=4NA(NA表示阿伏加德罗常数的值),故B正确;
,含氢原子数目2mol×2×NA=4NA(NA表示阿伏加德罗常数的值),故B正确;
C. 在0.5molNa2SO4中,含有的Na+数约0.5mol×2×6.02×1023mol-1=6.02×1023,故C正确;
D. 等质量的O2与O3,设质量都是m,所含氧原子数之比为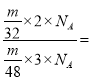 1:1,故D错误;
1:1,故D错误;
选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目