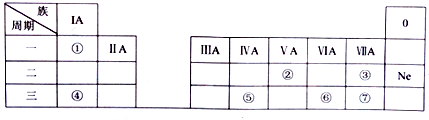
题目内容
2.下列有关说法正确的是( )| A. | 氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同 | |
| B. | SiO2是酸性氧化物,所以SiO2能与NaOH溶液反应 | |
| C. | 足量Cu与一定量浓硝酸充分反应得到的气体是纯净物 | |
| D. | NH3的水溶液可以导电,所以NH3是电解质 |
分析 A.氯气具有强氧化性,活性炭具有吸附性;
B.酸性氧化物能够与碱反应生成盐和水;
C.铜与浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮;
D.氨气本身不能电离出自由离子.
解答 解:A.氯气具有强氧化性,与水反应生成具有漂白性的HClO,可使品红褪色,活性炭具有吸附性,二者原理不同,故A错误;
B.SiO2是酸性氧化物,所以SiO2能与NaOH溶液反应生成硅酸钠和水,故B正确;
C.足量Cu与一定量浓硝酸充分反应,开始硝酸浓度大生成二氧化氮,随着反应进行硝酸浓度变小,反应生成一氧化氮,故C错误;
D.NH3的水溶液可以导电是因为氨气与水反应生成电解质一水合氨,氨气本身不能电离产生自由移动的离子,属于非电解质,故D错误;
故选:B.
点评 本题考查了元素化合物知识,熟悉氯气、硝酸、酸性氧化物的概念、电解质的概念是解题关键,题目难度不大.

练习册系列答案
相关题目
13.已知二氧化硒是一种氧化剂,它可有Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O制取.又知离子方程式aSeO2+bSO2+cH2O═aSe+bX+dY;则关于下列叙述正确的是( )
| A. | a:b=1:1 | |
| B. | Y为OH- | |
| C. | 氧化性为:SeO2>H2SO4(浓) | |
| D. | 若每生成0.2molX则该反应转移0.4NA个电子 |
10.某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解).
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加.
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰.
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+.
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O.
(3)甲同学最终确定原溶液中所含阳离子有Mg2+、Al3+,阴离子有Cl-、I-、NO3-、SO42-;并据此推测原溶液应该呈酸性,原因是Mg2++2H2O?Mg(OH)2+2H+、Al3++3H2O?Al(OH)3+3H+(请用离子方程式说明).
(4)在100mlHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L.向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大(反应前后溶液体积变化忽略不计),则H2SO4和HNO3两种酸的物质的量浓度之比为3:2.
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- I- |
Ⅰ、取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加.
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰.
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+.
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O.
(3)甲同学最终确定原溶液中所含阳离子有Mg2+、Al3+,阴离子有Cl-、I-、NO3-、SO42-;并据此推测原溶液应该呈酸性,原因是Mg2++2H2O?Mg(OH)2+2H+、Al3++3H2O?Al(OH)3+3H+(请用离子方程式说明).
(4)在100mlHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L.向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大(反应前后溶液体积变化忽略不计),则H2SO4和HNO3两种酸的物质的量浓度之比为3:2.
17.下列溶液中,溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 将80gSO3溶于水并配成1L的溶液 | |
| C. | 将0.5mol•L-1的NaNO3溶液100ml 加热蒸发掉50g水后的溶液 | |
| D. | 1L含K+为1mol的K2SO4溶液 |
7.物质的量相等的A、B两种气体,下列说法中错误的是( )
| A. | 分子数目一定相等 | B. | 体积一定相等 | ||
| C. | 质量不一定相等 | D. | 分子中的原子数目可能相等 |
14.除去下列各物质中的少量杂质(括号中的物质为杂质),所选试剂和方法都正确的是( )
| 物质 | 除杂试剂 | 除杂方法 | |
| A | 乙烷(乙烯) | 氢气 | 加热 |
| B | 乙酸(乙醇) | 氢氧化钠溶液 | 蒸发 |
| C | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| D | 溴苯(苯) | 溴水 | 常温 |
| A. | A | B. | B | C. | C | D. | D |
11.元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下表所列是五种短周期元素的原子半径及主要化合价(已知锂的原子半径为0.152nm).
(1)用元素符号标出A、B、C、D四种元素在元素周期表(如表)中的位置;
(2)E元素处于周期表中的第二周期第ⅣA族;
(3)A、B、D的简单离子的半径由大到小的顺序为Cl->O2->Mg2+(填离子符号);
(4)用电子式表示化合物DB2形成的过程: ;
;
(5)F为E的同族相邻元素,其非金属性:E>F(填“>”或“<”),设计一个简单实验加以验证:将二氧化碳通入硅酸钠溶液中,有胶状物生成,证明碳酸的酸性比硅酸强,则碳元素的非金属性比硅元素强(简要说明实验步骤、现象和仪器自选).
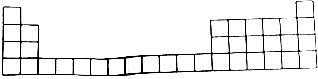
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.074 | 0.099 | 0.110 | 0.160 | 0.077 |
| 主要化合价 | -2 | +7、-1 | +5,-3 | +2 | +4、-4 |
(2)E元素处于周期表中的第二周期第ⅣA族;
(3)A、B、D的简单离子的半径由大到小的顺序为Cl->O2->Mg2+(填离子符号);
(4)用电子式表示化合物DB2形成的过程:
 ;
;(5)F为E的同族相邻元素,其非金属性:E>F(填“>”或“<”),设计一个简单实验加以验证:将二氧化碳通入硅酸钠溶液中,有胶状物生成,证明碳酸的酸性比硅酸强,则碳元素的非金属性比硅元素强(简要说明实验步骤、现象和仪器自选).

12.下列依据热化学方程式得出的结论正确的是( )
| A. | 由C(s,石墨)═C(s,金刚石)△H>0可知,金刚石比石墨稳定 | |
| B. | CO(g)的燃烧热是283.0kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+283.0kJ•mol-1 | |
| C. | 已知C(s)+O2(g)═2CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2,则△H1>△H2 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H<0,该反应的化学能可以转化为电能 |