题目内容
11.元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下表所列是五种短周期元素的原子半径及主要化合价(已知锂的原子半径为0.152nm).| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.074 | 0.099 | 0.110 | 0.160 | 0.077 |
| 主要化合价 | -2 | +7、-1 | +5,-3 | +2 | +4、-4 |
(2)E元素处于周期表中的第二周期第ⅣA族;
(3)A、B、D的简单离子的半径由大到小的顺序为Cl->O2->Mg2+(填离子符号);
(4)用电子式表示化合物DB2形成的过程:
 ;
;(5)F为E的同族相邻元素,其非金属性:E>F(填“>”或“<”),设计一个简单实验加以验证:将二氧化碳通入硅酸钠溶液中,有胶状物生成,证明碳酸的酸性比硅酸强,则碳元素的非金属性比硅元素强(简要说明实验步骤、现象和仪器自选).
分析 短周期元素中,B有+7、-1价,则B为Cl;A有-2价,处于ⅥA族,原子半径小于Cl,故A为O元素;C有+5、-3价,处于VA族,原子半径大于Cl,故C为P元素;D有+2价,原子半径大于P,故D为Mg;E有+4、-4价,处于ⅣA族,原子半径小于Cl,故E为C元素;
(1)A处于第二周期ⅥA族,B、C、D处于第三周期,分别处于17列、15列、12列;
(2)主族元素周期数=电子层数,主族族序数=最外层电子数;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
(4)MgCl2由镁离子与氯离子构成,用Mg原子、Cl原子电子式表示其形成过程;
(5)F为E的同族相邻元素,则F为Si,同主族自上而下非金属性减弱,利用最高价含氧酸中强酸制备弱酸进行验证.
解答 解:短周期元素中,B有+7、-1价,则B为Cl;A有-2价,处于ⅥA族,原子半径小于Cl,故A为O元素;C有+5、-3价,处于VA族,原子半径大于Cl,故C为P元素;D有+2价,原子半径大于P,故D为Mg;E有+4、-4价,处于ⅣA族,原子半径小于Cl,故E为C元素;
(1)O处于第二周期ⅥA族,Cl、P、Mg处于第三周期,分别处于17列、15列、12列,在周期表中位置: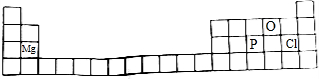 ,
,
故答案为: ;
;
(2)E为C元素,原子核外有2个电子层,最外层电子数为4,处于周期表中第二周期ⅣA族,故答案为:二;ⅣA;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:Cl->O2->Mg2+,故答案为:Cl->O2->Mg2+;
(4)MgCl2由镁离子与氯离子构成,用Mg原子、Cl原子电子式表示其形成过程为: ,
,
故答案为: ;
;
(5)F为E的同族相邻元素,则F为Si,同主族自上而下非金属性减弱,故非金属性C>Si,利用最高价含氧酸中强酸制备弱酸进行验证,具体方案为:将二氧化碳通入硅酸钠溶液中,有胶状物生成,证明碳酸的酸性比硅酸强,则碳元素的非金属性比硅元素强,
故答案为:>;将二氧化碳通入硅酸钠溶液中,有胶状物生成,证明碳酸的酸性比硅酸强,则碳元素的非金属性比硅元素强.
点评 本题考查元素周期表与元素周期律应用,比较基础,注意金属性、非金属性强弱比较实验事实.

| X | ||||
| Y | Z | |||
| W |
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | Y、Z的氢化物有可能含非极性键 | |
| C. | Z、W形成的化合物W显负价 | |
| D. | Y分别与Z、W形成的化合物全部都是非极性分子 |
| A. | 氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同 | |
| B. | SiO2是酸性氧化物,所以SiO2能与NaOH溶液反应 | |
| C. | 足量Cu与一定量浓硝酸充分反应得到的气体是纯净物 | |
| D. | NH3的水溶液可以导电,所以NH3是电解质 |
| A. | 1mol CH2=CHCH3中含有σ键数为9NA | |
| B. | Na2O2与足量H2O反应,当生成0.1mol O2时,转移电子的数目为0.2NA | |
| C. | 1L 1.0mol/L CH3COONa溶液与2L 0.5mol/L CH3COONa溶液都含有NA个CH3COO- | |
| D. | 粗铜电解精炼纯铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
| A. | 碳酸钠和碳酸氢钠均可用作食用碱 | B. | 液氮可用作制冷剂 | ||
| C. | 二氧化硫可用于食品增白 | D. | 漂粉精可用于环境杀菌消毒 |
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的10倍 | |
| C. | AgCl在同浓度的CaCl2的NaCl溶液中的溶解度相同 | |
| D. | 用0.1000mol•L-1NaOH溶液滴定浓度相近的甲酸时,用酚酞做指示剂 |
| A. | 乙烯的分子式为C2H4 | B. | 羟基的电子式为 | ||
| C. | 乙醇的结构简式为C2H6O | D. | 乙烷的结构简式为CH3CH3 |
| A. | 2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | |
| B. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | |
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | |
| D. | K2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2K+H2O |
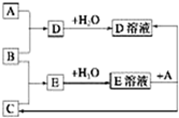 已知A、B、C为中学化学中常见的单质,室温下A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.下列说法正确的是( )
已知A、B、C为中学化学中常见的单质,室温下A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.下列说法正确的是( )| A. | A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物 | |
| B. | A、B、C中有一种金属且为B | |
| C. | 如果E溶液是一种强酸,则E溶液为硫酸 | |
| D. | A、B、C中三种元素的任意两种元素形成的化合物所属物质类别一定不是碱 |