题目内容
17.下列溶液中,溶质的物质的量浓度为1mol•L-1的是( )| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 将80gSO3溶于水并配成1L的溶液 | |
| C. | 将0.5mol•L-1的NaNO3溶液100ml 加热蒸发掉50g水后的溶液 | |
| D. | 1L含K+为1mol的K2SO4溶液 |
分析 A.氢氧化钠溶于1L水中,所得溶液的体积不是1L;
B.80g三氧化硫的物质的量为1mol,1mol三氧化硫与水反应生成1mol硫酸,所得溶液浓度为1mol/L;
C.蒸发掉50g水后溶液体积不是50mL;
D.钾离子难度为1mol/L,而硫酸钾的浓度为0.5mol/L.
解答 解:A.40g氢氧化钠的物质的量为:$\frac{40g}{40g/mol}$=1mol,1molNaOH溶于1L水中,所得溶液体积不是1L,则溶液的浓度不是1mol/L,故A错误;
B.80g三氧化硫的物质的量为:$\frac{80g}{80g/mol}$=1mol,1mol三氧化硫溶于水生成1mol硫酸,则所得溶液浓度为1mol/L,故B正确;
C.加热蒸发掉50g水后的溶液体积不是50mL,则溶液浓度不是1mol/L,故C错误;
D.1L含K+为1mol的K2SO4溶液中,钾离子浓度为1mol/L,而硫酸钾的浓度为0.5mol/L,故D错误;
故选B.
点评 本题考查了物质的量浓度的计算与判断,题目难度中等,明确物质的量浓度的概念及计算方法为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
7.对于放热反应,下列说法中正确的是( )
| A. | 反应物的总能量一定低于生成物的总能量 | |
| B. | 所有的中和反应都为放热反应 | |
| C. | 破坏反应物中的化学键所吸收的总能量大于形成生成物中化学键所放出的总能量 | |
| D. | 放热反应,不必加热就可发生 |
5.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
| A. | 对反应体系加热 | B. | 改用体积大的反应容器 | ||
| C. | 加入少量硫酸铜溶液 | D. | 改用铁粉代替铁片 |
12.下列试剂不会因为空气的氧气而变质的是( )
| A. | 硅酸钠溶液 | B. | 硫酸亚铁溶液 | C. | 亚硫酸钠溶液 | D. | 氢硫酸 |
2.下列有关说法正确的是( )
| A. | 氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同 | |
| B. | SiO2是酸性氧化物,所以SiO2能与NaOH溶液反应 | |
| C. | 足量Cu与一定量浓硝酸充分反应得到的气体是纯净物 | |
| D. | NH3的水溶液可以导电,所以NH3是电解质 |
6.化学与生活密切相关,下列说法错误的是( )
| A. | 碳酸钠和碳酸氢钠均可用作食用碱 | B. | 液氮可用作制冷剂 | ||
| C. | 二氧化硫可用于食品增白 | D. | 漂粉精可用于环境杀菌消毒 |
7.下列关于化学用语和化学基本概念的表述中正确的一组是( )
| A. | 160与180互为同位素;H${\;}_{2}^{16}$O、D${\;}_{2}^{18}$O、D${\;}_{2}^{18}$0互为同素异形体 | |
| B. | SiH4、PH3、HCl的稳定性逐渐增强 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | Ca2+的结构示意图为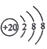 NH4Cl的电子式为 NH4Cl的电子式为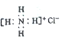 |
 氧化-还原反应是中学化学中一类重要的反应类型,在日常生活中很常见,请回答:(1)在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中.当产生标况下4.48L气体时,消耗单质铜19.2g,此时转移了0.6mol电子.
氧化-还原反应是中学化学中一类重要的反应类型,在日常生活中很常见,请回答:(1)在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中.当产生标况下4.48L气体时,消耗单质铜19.2g,此时转移了0.6mol电子.