题目内容
12.表中是元素周期的一部分,除标出的元素外,表中的每个编号代表一种元素.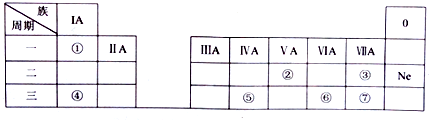
请根据要求回答问题.
(1)④的元素符号是Na.
(2)②、③两种元素的原子半径大小比较:②>③(填“>”或“<”).
(3)元素①的一种氧化物,具有强氧化性和消毒杀菌能力,其化学为H2O2.
(4)①~⑦元素中最高正价与最低负价的代数和为0的元素在周期表中的位置第一周期IA族、第三周期ⅣA族.
(5)元素⑥的一种氧化物具有漂白性,该氧化物与元素⑦的单质,按体积比1:1通入品红溶液中,观察到品红溶液不褪色,写出其反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
分析 (1)由元素在周期表中位置,可知①为H、②为N、③为F、④为Na、⑤为Si、⑥为S、⑦为Cl;
(2)同周期自左而右原子半径减小;
(3)氢元素的一种氧化物具有强氧化性和消毒杀菌能力,该氧化物为过氧化氢;
(4)①~⑦元素中最高正价与最低负价的代数和为0的元素有H元素、Si元素;
(5)元素⑥的一种氧化物具有漂白性,该氧化物为SO2,与氯气按体积比1:1通入品红溶液中发生反应:SO2+Cl2+2H2O=H2SO4+2HCl.
解答 解:(1)由元素在周期表中位置,可知①为H、②为N、③为F、④为Na、⑤为Si、⑥为S、⑦为Cl,故答案为:Na;
(2)同周期自左而右原子半径减小,故原子半径②>③,故答案为:>;
(3)氢元素的一种氧化物具有强氧化性和消毒杀菌能力,该氧化物为H2O2,故答案为:H2O2;
(4)①~⑦元素中最高正价与最低负价的代数和为0的元素有H元素、Si元素,分别处于第一周期IA族、第三周期ⅣA族,故答案为:第一周期IA族、第三周期ⅣA族;
(5)元素⑥的一种氧化物具有漂白性,该氧化物为SO2,与氯气按体积比1:1通入品红溶液中发生反应:SO2+Cl2+2H2O=H2SO4+2HCl,二者恰好反应,品红溶液不褪色,反应离子方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-,故答案为:不褪色;SO2+Cl2+2H2O=4H++SO42-+2Cl-.
点评 本题考查元素周期表与元素周期律的应用,题目难度不大,试题侧重对基础知识的巩固,注意理解掌握元素周期律内容、元素周期表结构.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
15.下列实验操作,现象和结论均正确的是
| 实验操作 | 现象 | 结论 | |
| A | 稀硫酸滴入碳酸钠溶液中,将产生的气体通入盛有硅酸钠溶液的烧杯中 | 烧杯中产生白色胶状沉淀 | 非金属性:S>C>Si |
| B | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 将饱和氯化铁溶液滴入盛有沸水的烧杯中,继续煮沸至溶液呈红褐色,停止加热,用激光笔照射烧杯中的液体 | 看到一条光亮的“通路” | 证明生成了氢氧化铁沉淀 |
| D | 在分液漏斗中加入碘水后再加入CCl4,充分振荡、静置 | 分层,且上层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
12.A元素原子的M层有3个电子,B元素原子的L层有6个电子,则A,B两元素形成的化合物的化学式式量为( )
| A. | 59 | B. | 102 | C. | 114 | D. | 150 |
7.对于放热反应,下列说法中正确的是( )
| A. | 反应物的总能量一定低于生成物的总能量 | |
| B. | 所有的中和反应都为放热反应 | |
| C. | 破坏反应物中的化学键所吸收的总能量大于形成生成物中化学键所放出的总能量 | |
| D. | 放热反应,不必加热就可发生 |
17.某有机物在氧气力充分燃烧,生成的CO2和H2O的物质的量之比为1:2,由此可以得出的结论是( )
| A. | 该有机物一定含有氧元素 | B. | 该有机物一定不含氧元素 | ||
| C. | 该有机物一定是甲烷 | D. | 该有机物可能是甲烷 |
1.短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示.下列说法正确的是( )
| X | ||||
| Y | Z | |||
| W |
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | Y、Z的氢化物有可能含非极性键 | |
| C. | Z、W形成的化合物W显负价 | |
| D. | Y分别与Z、W形成的化合物全部都是非极性分子 |
2.下列有关说法正确的是( )
| A. | 氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同 | |
| B. | SiO2是酸性氧化物,所以SiO2能与NaOH溶液反应 | |
| C. | 足量Cu与一定量浓硝酸充分反应得到的气体是纯净物 | |
| D. | NH3的水溶液可以导电,所以NH3是电解质 |
 原子序数依次增大的前四周期五种元素X、Y、Z、M、W.已知X的一种单质是原子晶体,且是自然界中最坚硬的物质,Y原子最外层电子数是次外层的3倍,M与Y同主族,且M元素的单质为淡黄色;Z与M同周期,且Z元素与Y元素可以形成两种化合物,其中一种化合物也为淡黄色;W是生活中使用最广泛的金属元素,且有+2和+3两种常见化合价.据此回答:
原子序数依次增大的前四周期五种元素X、Y、Z、M、W.已知X的一种单质是原子晶体,且是自然界中最坚硬的物质,Y原子最外层电子数是次外层的3倍,M与Y同主族,且M元素的单质为淡黄色;Z与M同周期,且Z元素与Y元素可以形成两种化合物,其中一种化合物也为淡黄色;W是生活中使用最广泛的金属元素,且有+2和+3两种常见化合价.据此回答: 1834年,德国科学家米希尔里希通过蒸馏苯甲酸和石灰的混合物,得到了鱼法拉第所制液体相同的一种液体,并命名为苯.后来,法国化学家热拉尔等人又确定了苯的分子式为C6H6.
1834年,德国科学家米希尔里希通过蒸馏苯甲酸和石灰的混合物,得到了鱼法拉第所制液体相同的一种液体,并命名为苯.后来,法国化学家热拉尔等人又确定了苯的分子式为C6H6.