题目内容
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因:______________;农业上用石膏降低其碱性的反应原理:__________。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”“<”或“=”)n。
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=__________。
(4)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
【答案】Na2CO3+H2O![]() NaHCO3+NaOH Na2CO3+CaSO4=CaCO3+Na2SO4 < 1.0×10-8 mol·L-1 中
NaHCO3+NaOH Na2CO3+CaSO4=CaCO3+Na2SO4 < 1.0×10-8 mol·L-1 中 ![]()
【解析】
(1)碳酸钠在溶液中水解使溶液显碱性,导致盐碱地呈碱性,水解的化学方程式为Na2CO3+H2O ![]() NaHCO3+NaOH;向盐碱地中加入石膏(CaSO4),CaSO4和Na2CO3反应生成硫酸钠和碳酸钙,反应的化学方程式为:Na2CO3+CaSO4=CaCO3+Na2SO4,盐碱地中碳酸钠的浓度减小,使盐碱地中氢氧根浓度减小,碱性减弱,故答案为:Na2CO3+H2O
NaHCO3+NaOH;向盐碱地中加入石膏(CaSO4),CaSO4和Na2CO3反应生成硫酸钠和碳酸钙,反应的化学方程式为:Na2CO3+CaSO4=CaCO3+Na2SO4,盐碱地中碳酸钠的浓度减小,使盐碱地中氢氧根浓度减小,碱性减弱,故答案为:Na2CO3+H2O ![]() NaHCO3+NaOH;Na2CO3+CaSO4=CaCO3+Na2SO4;
NaHCO3+NaOH;Na2CO3+CaSO4=CaCO3+Na2SO4;
(2)氨水中存在电离平衡,稀释促进一水合氨的电离,使溶液中氢氧根的物质的量增加,而氢氧化钠在溶液中完全电离,不存在电离平衡,所以要使稀释的后的pH相等,氨水稀释的倍数大于氢氧化钠溶液,即m<n,故答案为:<;
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中醋酸的电离程度大于醋酸根的水解程度,醋酸电离出的氢离子抑制水的电离,则由水电离出来的c(OH-)=![]() mol/L=1×10-8mol/L,故答案为:1×10-8mol/L;
mol/L=1×10-8mol/L,故答案为:1×10-8mol/L;
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3H2O的电离常数Kb= 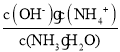 =
=![]() =
=![]() ,故答案为:中;
,故答案为:中;![]() 。
。

【题目】一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)=Y(s)+2Z(g) ΔH>0,反应达到最大限度前,测得X的浓度与反应时间的数据如表所示:
反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/mol·L-1 | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
试回答下列问题:
(1)0~3min内,用Z表示的平均反应速率v(Z)=___。
(2)分析该反应中反应物的浓度随时间的变化规律,得出的结论是___。由此结论推出a为___。
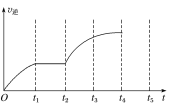
(3)该反应的逆反应速率随时间变化的关系如图所示,t2时改变了某一反应条件,则改变的条件为___。