题目内容
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,![]() 的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是![]()
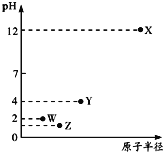
A.简单离子半径:![]()
B.Y与W形成的化合物分子可能是非极性分子
C.基态原子的第一电离能:![]()
D.X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
【答案】B
【解析】
第三周期元素中,X最高价氧化物水化物的溶液pH为12,氢氧根浓度为![]() ,故为一元强碱,则X为Na;Y、W、Z对应的最高价氧化物水化物的溶液pH均小于7,均为酸,W最高价含氧酸溶液中氢离子浓度为
,故为一元强碱,则X为Na;Y、W、Z对应的最高价氧化物水化物的溶液pH均小于7,均为酸,W最高价含氧酸溶液中氢离子浓度为![]() ,故为一元强酸,则W为Cl元素;最高价含氧酸中,Z对应的酸性比W的强、Y对应的酸性比W的弱,而原子半径
,故为一元强酸,则W为Cl元素;最高价含氧酸中,Z对应的酸性比W的强、Y对应的酸性比W的弱,而原子半径![]() ,硅酸不溶于水,故Z为S元素,Y为P元素。据此来分析选项即可。
,硅酸不溶于水,故Z为S元素,Y为P元素。据此来分析选项即可。
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径![]() ,故A错误;
,故A错误;
B.Y与W形成的化合物分子![]() ,结构对称,不存在孤对电子,正负电荷重心重叠,是非极性分子,故B正确;
,结构对称,不存在孤对电子,正负电荷重心重叠,是非极性分子,故B正确;
C.P最外层为半充满结构,性质稳定,难以失去电子,第一电离能大于S元素,故C错误;
D.X和Y的最高价氧化物对应的水化物分别为NaOH、磷酸,恰好中和生成磷酸钠,溶液中磷酸根水解,溶液呈碱性,故D错误;
答案选B。

练习册系列答案
相关题目