题目内容
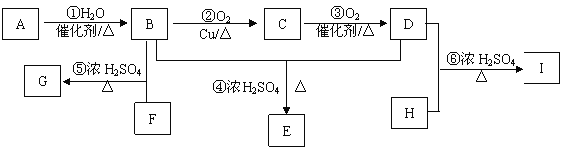
【题目】某气态烃A 与 H2的相对密度为14,其产量可以用来衡量一个国家的石油化工发展水平。以该化合物为原枓合成化合物G、E和I的流程如下:
已知:Ⅰ.芳香族化合物F为C、H、O化合物,其相对分子质量为166,环上的一氯代物有一种,1 mol F与足量NaHCO3溶液反应能生成2 mol CO2,F与足量B反应生成G。
Ⅱ.H为二元醇,其蒸气密度折算成标准状况为2.77 g/L,H与足量D反应生成I。
(1)A的电子式为____________________,E的结构简式____________________________________。
(2)G的分子式为______________,反应⑤的反应类型为________________。
(3)写出下列化学方程式:
②__________________________________________________________________;
⑥_______________________________________________________________;
【答案】 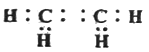 CH3COOCH2CH3 C12H14O4 酯化反应 2CH3CH2OH+O2
CH3COOCH2CH3 C12H14O4 酯化反应 2CH3CH2OH+O2![]() 2CH3CHO + 2H2O 2CH3COOH + HOCH2CH2OH
2CH3CHO + 2H2O 2CH3COOH + HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3 + 2H2O
CH3COOCH2CH2OOCCH3 + 2H2O
【解析】某气态烃A与H2的相对密度为14,该气体的相对分子质量为28,其产量可以用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,C进一步发生氧化反应生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3;芳香族化合物F为C、H、O化合物,1mol F与足量NaHCO3溶液反应能生成2mol CO2,则F含有2个羧基,其相对分子质量为166,2个羧基、1个C6H4的总式量为45×2+(12×6+4)=166,则F含有1个苯环、2个羧基,且环上的一氯代物有一种,则F为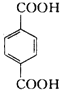 ,F与足量的B发生酯化反应生成G为
,F与足量的B发生酯化反应生成G为![]() ,H为二元醇,其蒸气密度折算成标准状况为2.77g/L,其相对分子质量为22.4×2.77=62,去掉2个羟基剩余基团式量为62-17×2=28,故为-C2H4-,则H为HOCH2CH2OH,H与足量D反应生成I为
,H为二元醇,其蒸气密度折算成标准状况为2.77g/L,其相对分子质量为22.4×2.77=62,去掉2个羟基剩余基团式量为62-17×2=28,故为-C2H4-,则H为HOCH2CH2OH,H与足量D反应生成I为![]() ,则
,则
(1)A是乙烯,电子式为![]() ,E的结构简式CH3COOCH2CH3。(2)G为
,E的结构简式CH3COOCH2CH3。(2)G为![]() ,分子式为C12H14O4,反应⑤的反应类型为酯化反应或取代反应;(3)②为乙醇的催化氧化,反应方程式为2CH3CH2OH+O2
,分子式为C12H14O4,反应⑤的反应类型为酯化反应或取代反应;(3)②为乙醇的催化氧化,反应方程式为2CH3CH2OH+O2![]() 2CH3CHO + 2H2O;反应⑥的化学方程式为:2CH3COOH + HOCH2CH2OH
2CH3CHO + 2H2O;反应⑥的化学方程式为:2CH3COOH + HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3 + 2H2O。
CH3COOCH2CH2OOCCH3 + 2H2O。

 名校课堂系列答案
名校课堂系列答案【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32。
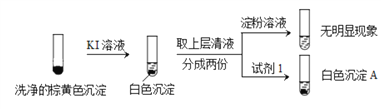
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32的理由是_______________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和____________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i. Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
将对比实验方案补充完整。
步骤一:
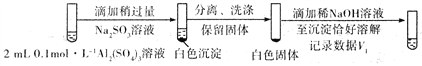
步骤二:

则V1___________V2(填>,<或=)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。