题目内容
【题目】CO和H2均是重要的化工原料,CO2的固定和利用对环境保护及能源开发具有重要的意义。
(1)利用水煤气(CO+H2)作为合成气,在同一容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚(CH3OCH3)。
甲醇合成反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.8kJ·mol-1
CH3OH(g) △H1=-90.8kJ·mol-1
水煤气变换反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.3kJ·mol-1
CO2(g)+H2(g) △H2=-41.3kJ·mol-1
甲醇脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
写出由CO和H2合成二甲醚气体和水蒸气的热化学方程式____________。
(2)在2L恒容密闭容器中,投入CO(g)和H2(g)各5mol,发生如下反应:
3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
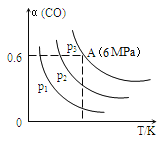
①p1、p2、p3中最大的是________。
②若该反应进行50min时达到平衡,此时CO的转化率α=0.6,则50min内H2的反应速率为____mol·L-1·min-1。
(3)二甲醚(CH3OCH3)燃料电池具有启动快。效率高等优点,其能量密度高于甲醇燃料电池。其工作原理如图所示。X极附近的酸性______(填“减弱”、“增强”或“不变”),Y电极是_____极,写出X电极上发生的电极反应式__________。若用该二甲醚燃料电池电解饱和食盐水(阳极为石墨电极),当有2.3g燃料被消耗时,阴极产生气体的体积为_____L(标准状况下)

【答案】(1)2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H=-205.1kJ·mol-1 (2) ①p1 ②0.03 (3) 增强 正极 CH3OCH3-12e-+3H2O=2CO2↑+12H+ 6.72
CH3OCH3(g)+H2O(g) △H=-205.1kJ·mol-1 (2) ①p1 ②0.03 (3) 增强 正极 CH3OCH3-12e-+3H2O=2CO2↑+12H+ 6.72
【解析】(1)①CO(g)+2H2(g)═CH3OH(g)△H1=-90.8kJmol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-23.5kJmol-1
依据盖斯定律①×2+②得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=(-90.8kJmol-1)×2+(-23.5kJmol-1)=-205.1kJmol-1;
(2)①3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g),可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,一氧化碳的转化率提高,因此压强关系是p1<p2<p3,即压强最大的是p3;
②反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) 进行50min时达到平衡,此时CO的转化率α=0.6,则变化的CO为3mol,变化的H2也为3mol,H2的反应速率为
CH3OCH3(g)+CO2(g) 进行50min时达到平衡,此时CO的转化率α=0.6,则变化的CO为3mol,变化的H2也为3mol,H2的反应速率为![]() =0.03mol·L-1·min-1。
=0.03mol·L-1·min-1。
(3)③电池在放电过程中,电极X发生的电极反应为(CH3)2O-12e-+3H2O=2CO2+12H+,X电极周围溶液的酸性增强;c处通入的气体是氧气,发生还原反应,则Y极为正极;当有2.3g燃料被消耗时,被氧化的二甲醚的物质的量为2.3g÷46g/mol=0.05mol,转移电子的物质的量为0.05mol×12=0.6mol,电解饱和食盐水(阳极为石墨电极),阴极产生氢气的体积为![]() ×22.4L/mol=6.72。
×22.4L/mol=6.72。

【题目】下列物质的性质与实际应用对应关系错误的是( )
选项 | 物质的性质 | 实际应用 |
A | 二氧化锰具有强氧化性 | 用作H2O2分解的氧化剂 |
B | 液氨汽化时要吸收大量的热 | 用作制冷剂 |
C | Al2O3熔点高 | 用作耐高温材料 |
D | 肥皂水显碱性 | 用作蚊虫叮咬处的清洗剂 |
A.A
B.B
C.C
D.D


