题目内容
10.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )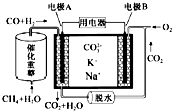
| A. | 反应CH4+H2O$\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1mol CH4转移12mol电子 | |
| B. | 电池工作时,CO32-向电极B移动 | |
| C. | 电极B上发生的电极反应为O2+2CO2+4e-═2CO32- | |
| D. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O |
分析 甲烷和水经催化重整生成CO和H2,反应中C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32-,以此解答该题.
解答 解:A.反应CH4+H2O$\frac{\underline{催化剂}}{△}$3H2+CO,C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1molCH4转移6mol电子,故A错误;
B.电池工作时,CO32-向负极移动,即向电极A移动,故B错误;
C.B为正极,正极为氧气得电子生成CO32-,反应为O2+2CO2+4e-=2CO32-,故C正确;
D.电解质没有OH-,负极电极A反应为H2+CO+2CO32--4e-=H2O+3CO2,故D错误.
故选C.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.在下列实验中,所选用的仪器合理的是( )
| A. | 用50 mL量筒量取5.2 mL稀硫酸 | |
| B. | 用坩埚加热氯化钠溶液得到到氯化钠晶体 | |
| C. | 用托盘天平称量1.17g氯化钠晶体 | |
| D. | 用250 mL容量瓶配制250 mL 0.2 mol/L的NaOH溶液 |
5. 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C$\frac{\underline{\;←\;}}{\;}$O)
由此计算△H1=-99kJ•mol-1,已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
(2)在25℃、101KPa下,每充分燃烧1g CH3OH并恢复到原状态,会释放22.68KJ的热量.请写出表示甲醇燃烧热的热化学反应方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
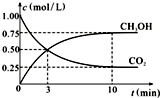
(3)对于第二个反应方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在一恒温恒容密闭容器中充入1molCO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示.试回答:0~10min内,氢气的平均反应速率为0.225mol•L-1•mm-1.该反应平衡常数表达式$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$.第10min后,若向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时CH3OH(g)的体积分数变大(填“变大”、“减少”或“不变”).该反应的平衡常数不变(填“变大”、“变小”或“不变”).
 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C$\frac{\underline{\;←\;}}{\;}$O)
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)在25℃、101KPa下,每充分燃烧1g CH3OH并恢复到原状态,会释放22.68KJ的热量.请写出表示甲醇燃烧热的热化学反应方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
(3)对于第二个反应方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在一恒温恒容密闭容器中充入1molCO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示.试回答:0~10min内,氢气的平均反应速率为0.225mol•L-1•mm-1.该反应平衡常数表达式$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$.第10min后,若向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时CH3OH(g)的体积分数变大(填“变大”、“减少”或“不变”).该反应的平衡常数不变(填“变大”、“变小”或“不变”).
2.下列说法中正确的是( )
| A. | 对于2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol.若反应中充入1mol SO2和足量的氧气反应时.放出的热量一定是Q/2kJ | |
| B. | 热化学方程式中的化学计量数表示反应物及生成物的物质的量,可以是分数 | |
| C. | 1molH2与0.5加O2反应放出的热量就是H2的燃烧热 | |
| D. | 1mol H2SO4溶液与1mol Ba(OH)2溶液反应生成BaSO4沉淀时放出的热量叫中和热 |
19.室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?a=7时HA是强酸,a>7时HA是弱酸
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=9.9×10-7mol/L.
| 实验 编号 | HA的物质的量 浓度(mol/L) | NaOH的物质的 量浓度(mol/L) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=8 |
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=9.9×10-7mol/L.

 某实验小组做钠与水反应的实验,装置如图所示.
某实验小组做钠与水反应的实验,装置如图所示.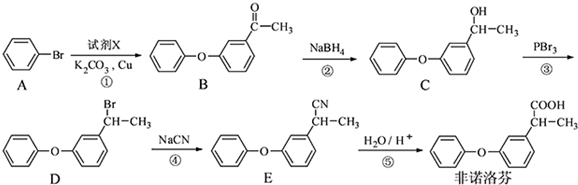
 .
.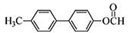 .
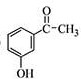
.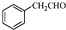 为原料制备
为原料制备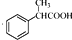 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).