题目内容
2.下列说法中正确的是( )| A. | 对于2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol.若反应中充入1mol SO2和足量的氧气反应时.放出的热量一定是Q/2kJ | |
| B. | 热化学方程式中的化学计量数表示反应物及生成物的物质的量,可以是分数 | |
| C. | 1molH2与0.5加O2反应放出的热量就是H2的燃烧热 | |
| D. | 1mol H2SO4溶液与1mol Ba(OH)2溶液反应生成BaSO4沉淀时放出的热量叫中和热 |
分析 A.根据1mol SO2和足量的氧气反应为可逆反应,不可能反应到底判断;
B.热化学方程式中的化学计量数表示物质的量,能为分数;
C.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
D.中和热是指稀的强酸和强碱反应生成1mol水时放出的热量.
解答 解:A.1mol SO2和足量的氧气反应为可逆反应,不可能反应到底,所以若反应中充入1mol SO2和足量的氧气反应时.放出的热量小于Q/2kJ,故A错误;
B.热化学方程式中的化学计量数表示物质的量,不表示分子数,所以能为分数,故B正确;
C.1 mol H2与0.5 mol O2反应生成液态水放出的热就是H2的燃烧热,故C错误;
D.中和热是指稀的强酸和强碱反应生成1mol水时放出的热量,而1mol H2SO4溶液与1mol Ba(OH)2溶液反应生成BaSO4沉淀和2mol水,故D错误.
故选B.
点评 本题考查了反应焓变的计算判断,燃烧热、中和热概念的分析应用,热化学方程式的表示意义,题目较简单.

练习册系列答案
相关题目
13.降解塑料能在微生物的作用下降解成二氧化碳和水,从而消除废旧塑料对环境的污染.PHB塑料就是一种生物降解塑料,其结构简式为: .下面有关PHB的说法不正确的是( )
.下面有关PHB的说法不正确的是( )
 .下面有关PHB的说法不正确的是( )
.下面有关PHB的说法不正确的是( )| A. | PHB是高分子化合物 | |
| B. | 合成PHB的单体是CH3CH2CH(OH)COOH | |
| C. | 通过缩聚反应可以制得PHB | |
| D. | 在PHB的降解过程中一定没有氧气参加反应 |
10.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
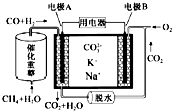

| A. | 反应CH4+H2O$\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1mol CH4转移12mol电子 | |
| B. | 电池工作时,CO32-向电极B移动 | |
| C. | 电极B上发生的电极反应为O2+2CO2+4e-═2CO32- | |
| D. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O |
8.22%的NaNO3溶液150mL中加入100g水后所得溶液质量分数为14%,则原NaNO3溶液物质的量浓度约为( ) mol/L.
| A. | 1.0 | B. | 2.0 | C. | 3.0 | D. | 4.0 |

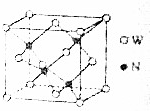 X、Y、Z、W、N是原子序数依次增大的前四周期元素,其中X的s能级电子数是p能级电子数的2倍,Y的原子核外有3个未成对电子,Z的基态原子M层与K层电子数相等,Y与Z的最外层电子数之和等于W的最外层电子数,N+原子核外有3个电子层且各层均处于全满状态.回答下列问题:
X、Y、Z、W、N是原子序数依次增大的前四周期元素,其中X的s能级电子数是p能级电子数的2倍,Y的原子核外有3个未成对电子,Z的基态原子M层与K层电子数相等,Y与Z的最外层电子数之和等于W的最外层电子数,N+原子核外有3个电子层且各层均处于全满状态.回答下列问题: