题目内容
15.25℃、1.01×105Pa时,氢硫酸饱和溶液的浓度为0.1mol•L-1,写出氢硫酸在溶液中的电离方程式H2S?HS-+H+、HS-?S2-+H+.若此时溶液的pH=4,向该溶液中滴入甲基橙试液,溶液显橙色.将变色后的溶液分成A、B、C、D四份,分别进行下列实验:(1)向A溶液中加入适量的碘水,恰好完全反应,反应的离子方程式为H2S+I2=2H++2I-+S↓,假设溶液的体积增大一倍,此时溶液的pH约为1;
(2)向B溶液中通入足量氧气,使H2S完全反应,静置后的溶液呈黄色,其pH约为7;
(3)向C溶液中加入少量Na2S晶体,振荡后溶液的pH将增大(填“增大”、“减小”或“不变”).
分析 硫化氢是二元弱酸,在水溶液里分步电离,甲基橙的变色范围是3.1-4.4,若溶液的pH=4,则向溶液中加入甲基橙,溶液呈橙色,
(1)碘和硫化氢反应生成硫单质和氢碘酸,根据氢离子浓度计算溶液的pH;
(2)硫化氢与氧气反应生成硫单质和水,溶液pH约为7,甲基橙溶液呈黄色;
(3)向硫化氢溶液中加入硫化钠固体,硫离子浓度增大,抑制硫化氢电离.
解答 解:硫化氢是二元弱酸,在水溶液里分步电离,第一步电离方程式为:H2S?HS-+H+,第二步电离方程式为:HS-?S2-+H+,甲基橙的变色范围是3.1-4.4,若溶液的pH=4,则向溶液中加入甲基橙,溶液呈橙色,
故答案为:H2S?HS-+H+、HS-?S2-+H+;橙;
(1)碘和硫化氢反应生成硫单质和氢碘酸,离子反应方程式为:H2S+I2=2H++2I-+S↓,氢碘酸是强酸,氢离子浓度是0.1mol•L-1,则溶液的pH=1,
故答案为:H2S+I2=2H++2I-+S↓;1;
(2)硫化氢与氧气反应生成S和水,反应后的溶液为中性,溶液的pH=7,则滴有甲基橙的溶液呈黄色,
故答案为:黄;7;
(3)向硫化氢溶液中加入硫化钠晶体,硫离子浓度增大,抑制硫化氢电离,导致溶液中氢离子浓度减小,所以pH增大,
故答案为:增大.
点评 本题考查弱电解质电离平衡及其影响、溶液pH的计算,题目难度中等,明确物质间的反应是解本题关键,注意氢碘酸是强酸,其酸性比盐酸强,且是强还原性酸.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
2.下列电离方程式中,正确的是( )
| A. | Na2SO4=2Na++SO4-2 | B. | Ba(OH)2=Ba2++OH2- | ||
| C. | Fe2(SO4)3=2Fe3++3SO42- | D. | Ca(NO3)2=Ca2++2(NO3)- |
20.X、Y均为短周期元素,两者组成化合物的化学式为X2Y3,已知X的原子序数为m,则Y的原子序数不可能是( )
| A. | m+11 | B. | m+4 | C. | m-6 | D. | m-5 |
7.下列情况下,反应速率相同的是( )
| A. | 等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应 | |
| B. | 等质量锌粒和锌粉分别与等量1 mol/L HCl反应 | |
| C. | 等体积等浓度HCl和CH3COOH分别与等质量的Na2CO3粉末反应 | |
| D. | 等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应 |
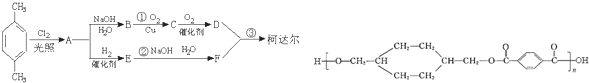
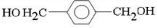 ;D
;D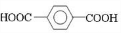 ;E
;E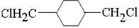
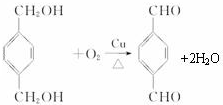 ,反应类型氧化反应
,反应类型氧化反应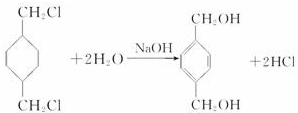 ,反应类型取代反应
,反应类型取代反应 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$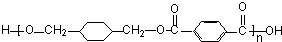 +(2n-1)H2O,反应类型缩聚反应.
+(2n-1)H2O,反应类型缩聚反应.

 ;
;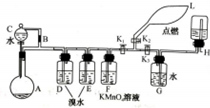 有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:
有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目: