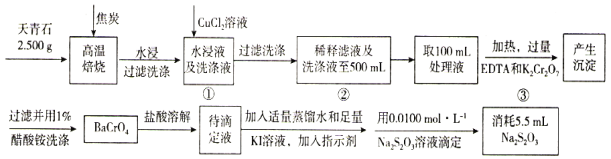
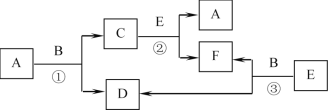
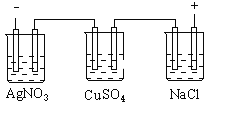
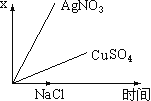
题目内容
【题目】有一种酸式盐AHB,它的水溶液显弱碱性,今有下列说法,其中正确的是
A.相同温度相同浓度的AOH溶液和H2B溶液,电离程度前者大于后者
B.HB—的电离程度大于HB—的水解程度
C.该盐的电离方程式为AHB=A++H++B2—
D.在溶液中离子浓度大小顺序一般为:c(A+)>c(OH—)>c(HB—)>c(B2—)>c(H+)
【答案】A
【解析】
酸式盐AHB,它的水溶液呈弱碱性,说明该盐中阴离子的水解程度大于电离程度,或是一种强碱弱酸盐,根据水解原理以及电离情况来判断。
A.若是强碱弱酸盐,则相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度,故A正确;
B.酸式盐AHB,它的水溶液呈弱碱性,说明该盐中阴离子的水解程度大于电离程度,HB-的电离程度小于HB-的水解程度,故B错误;
C.该盐溶液的电离方程式一般写成:AHB=A++HB-,HB-![]() H++B2-,故C错误;
H++B2-,故C错误;
D.酸式盐AHB,它的水溶液呈弱碱性,说明该盐中阴离子的水解程度大于电离程度,溶液中离子浓度大小为:c(A+)>c(HB-)>c(OH-)>c(B2-)>c(H+),故D错误。
故答案选A。

【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)