题目内容
【题目】早期发现的一种天然二十面体准晶颗粒由Cu、Fe、Al三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_________方法区分晶体、准晶体和非晶体。
(2)基态Cu原子最高能层符号_________,Cu位于周期表________区;新制备的Cu(OH)2可将丙醛(CH3CH2CHO)氧化成丙酸,而自身还原成Cu2O,Cu2O中Cu元素的化合价为_________。1mol丙醛分子中含有的σ键的数目为_________,丙酸的沸点明显高于丙醛,其主要原因是_________________。
(3)已知:
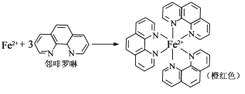
①Fe2+与邻啡罗啉形成的配合物(形成过程如图)中,配位体为_________________,配位原子数为__。
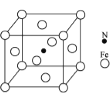
②铁能与氮形成一种磁性材料,其晶胞结构如图,则该磁性材料的化学式为___________。
③尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]。尿素分子中C、N原子的杂化方式分别是________、_________;与NO3-互为等电子体的一种化合物是_________(写化学式)。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为______,列式表示Al单质的密度_________________gcm﹣3(不必计算出结果)。
【答案】X射线衍射 N ds +1 9NA 乙酸存在分子间氢键  6 Fe4N sp2 sp3 SO3 12
6 Fe4N sp2 sp3 SO3 12 ![]()
【解析】
(1)区分晶体、准晶体和非晶体可用X射线衍射法;
(2)根据Cu的核外电子排布判断Cu的能级和在周期表中的位置;1个丙醛分子含有9个σ键,则1mol丙醛含有9molσ键;丙酸分子间可形成氢键,丙醛不能形成氢键,所以丙酸的沸点高于丙醛;
(3)①配位数就是在配位个体中与一个形成体成键的配位原子的总数;
②利用均摊法确定其化学式;
③由尿素的结构式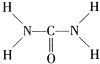 可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;原子总数相等,价电子总数相等的微粒为等电子体,利用代换法书写;
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;原子总数相等,价电子总数相等的微粒为等电子体,利用代换法书写;
(4)根据密度=质量/体积进行计算。
(1)从外观无法区分三者,但用X光照射挥发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定,故答案为:X射线衍射。
(2)Cu原子核外电子数为29,基态原子核外电子排布为1s22s22p63s23p63d104s1,电子占据的最高能层符号为N;Cu在周期表位于第四周期第IB,所以属于ds区;Cu2O中O元素的化合价为-2价,根据化合物的化合价代数和为0可知:Cu元素的化合价为+1价;1个丙醛分子含有9个σ键和一个π键,则1mol丙醛含有9molσ键,即9NA个σ键;丙酸分子间可形成氢键,丙醛不能形成氢键,所以丙酸的沸点高于丙醛;故答案为:N,ds,+1,9NA,丙酸存在分子间氢键。
(3)①配位数就是在配位个体中与一个形成体成键的配位原子的总数,所以Fe2+与邻啡罗啉形成的配合物(形成过程如图)中,配位体为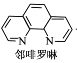 ,配位数为6,故答案为:
,配位数为6,故答案为: ,6。
,6。
②铁原子个数=8×![]() +6×
+6×![]() =4,氮原子个数是1,所以其化学式为Fe4N,故答案为:Fe4N。
=4,氮原子个数是1,所以其化学式为Fe4N,故答案为:Fe4N。
③由尿素分子的结构式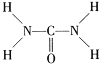 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;N原子最外层电子数为5,将N原子及1个单位负电荷,可以替换为S原子,故SO3与NO3-互为等电子体故答案为:sp2,sp3,SO3。
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;N原子最外层电子数为5,将N原子及1个单位负电荷,可以替换为S原子,故SO3与NO3-互为等电子体故答案为:sp2,sp3,SO3。
(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占1/2,通过一个顶点可形成8个晶胞,因此该晶胞中铝原子的配位数为8×3×![]() =12;一个晶胞中Al原子数为8×
=12;一个晶胞中Al原子数为8×![]() +6×
+6×![]() =4,因此Al的密度ρ=m/V=
=4,因此Al的密度ρ=m/V=![]() gcm﹣3,故答案为:12,
gcm﹣3,故答案为:12,![]() 。
。