��Ŀ����
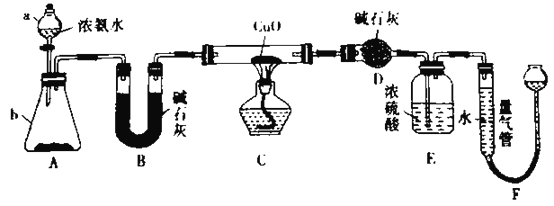
����Ŀ��ij��ѧ�о���ѧϰС��Ϊ�˽�ӹ�ҵ�����ᴿ��ķ������������й����ϣ�Br2�ķе�Ϊ59�棬����ˮ���ж��Ժ�ǿ��ʴ�ԡ����Dzι��������̺����������װ�ü�ͼ��
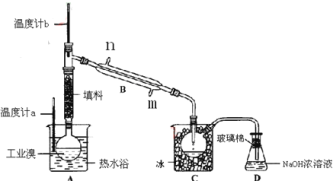
(1)װ��Bֱ�������ܽ�ˮ����______(����������������)��װ��D��������_________��
(2)��AԲ����ƿ�м���һ������ҵ���2СƬ���Ƭ���������Ƭ��������_________���������һ��ʱ��������Ǽ����Ƭ��Ӧ�ò�ȡ����ȷ������_______(����ȷ�𰸱��)��A���������� B����ȴ�� C�����貹�� D����������
(3)����ʵ��װ�����������Ӿ��������������ܣ���ԭ����_____________________��
(4)ʵ��װ�����������ã�Ҫ�ﵽ�ᴿ���Ŀ�ģ���������ο��ƹؼ�������___________��
(5)װ��C�����ã�_____________________��װ��D��������________________________��
(6)�ᴿҺ��ҲҪ�õ���Һ��������Һ©����ʹ��ǰ����ϴ�ɾ���___________����CCl4��ȡ��ʱ������Ӧ�ôӷ�Һ©����______________(�����Ͽڵ����������¿ڷų���)��
���𰸡��� ��ƿ ��ֹ���� B Br2��ʴ�� �����¶ȼ�b���¶ȣ����ռ�59������ �������ռ�Һ�� 2NaOH+ Br2=NaBr+ NaBrO+H2O ��© �¿ڷų�
��������
��1������ʵ���ҳ���������ʹ�÷����жϣ�
��2�����Ƭ������ֹ���У�������Ǽ����Ƭ��Ӧ��ȴ�ӣ�
��3�����������ǿ��ʴ�ԣ����Ը�ʴ������
��4�����ݷ��������û��Һ��ĸ��ɷַе㲻ͬ�������жϣ�
��5��װ��C�������壬��ֹ��ӷ���װ��D�����������ջӷ����壻
��6����Һ©����ʹ��ǰҪ��©��������Ȼ�̼��Һ���²㣬�ӷ�Һ©�����¿ڷų���
��1����������ʵ���ҳ�����������ʹ��ʱ����ˮ���¿ڽ����Ͽڳ�������ֱ�������ܴӢ����ˮ�����������Ľṹ��֪װ��D����������ƿ���ʴ�Ϊ������ƿ��
��2�����Ƭ��Ϊ�����кܶ�С�ף���ʵ���н�����Һ���Ȳ�����������ֹ���У����ƬӦ������Һ����ǰ���룬������Ǽ��룬Ϊ�˰�ȫ�����ҲӦ�ý���Һ��ȴ�����м��룬�ʴ�Ϊ��
��ֹ���У�B��
��3���������ǿ��ʴ�ԣ����Ը�ʴ����������ʵ��װ�����������Ӿ��������������ܣ��ʴ�Ϊ��Br2��ʴ��
��4����ķе�Ϊ59�棬���ݷе㲻ͬ���ᴿBr2���ɲ���ˮԡ���ȣ���ͨ���¶ȼ�b���ƺ��¶ȣ����ռ�59��ʱ����֣��ʴ�Ϊ�������¶ȼ�b���¶ȣ����ռ�59�����֡�
��5���ñ���ȴ��Ŀ���������壬��ֹ��ӷ���Br2�ж��������ŷ��ڻ����У�D�����������ջӷ����壬��Ӧ����ʽΪ��2NaOH+Br2=NaBr+ NaBrO+H2O���ʴ�Ϊ���������ռ�Һ�壻2NaOH+Br2=NaBr+ NaBrO+H2O��
��6����Һ©����ʹ��ǰ��©�DZ�Ҫ�������裬��CCl4��ȡ��ʱ����ΪCCl4���ܶȱ�ˮ���ܶȴ�������Ȼ�̼��Һ���²㣬�ӷ�Һ©�����¿ڷų����ʴ�Ϊ����©���¿ڷų���

 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д� �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�����Ŀ��ijУ��ѧ��ȤС���ͬѧ���õζ�����һ��������Na2SO4��NaOH��Ʒ��NaOH�ĺ������вⶨ����ش��������⣺
��1���÷�����ƽȷ��ȡ����Ʒ5.360g��ȫ������ˮ���Ƴ�1000.0mL����Һ���ü�ʽ�ζ���ȡ����20.00mL������ƿ�У��μӼ��μ�����ָʾ�����ñ���������Һ�ζ����������������Һʱ�����ְ�����ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע����____���ζ��յ��������____________��
��2�����в����п���ʹ��������������Һ��Ũ����ֵƫ�͵���_____(��д���)
A����ʽ�ζ���δ�ñ�������Һ��ϴ��ֱ��ע���������Һ
B���ζ�ǰʢ������������Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D����ȡ�������ʱ���ζ�����ʱ���Ӷ���
��3�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ����ζ��յ�Ķ���Ϊ____mL��

��4��ijѧ����������ʵ��ֱ��¼�й��������£�
�ζ����� | ��������������Һ�����/mL | 0.1000mol/L����������mL�� | ||
�ζ�ǰ�̶� | �ζ���̶� | |||
��1�� | 20.00 | 0.00 | 26.01 | |
��2�� | 20.00 | 1.56 | 30.30 | |
��3�� | 20.00 | 0.22 | 26.21 | |
��ѡ�����к�����������ʽ���������Ʒ��NaOH�������ٷֺ�����(д���������)__