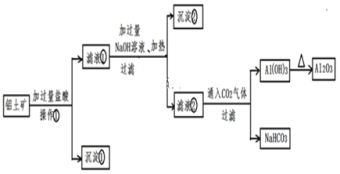
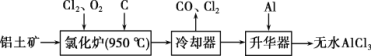
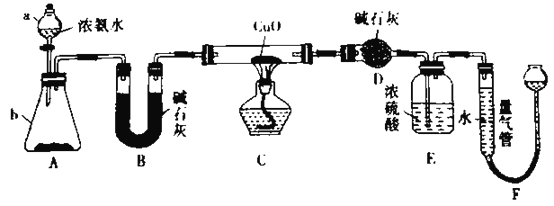
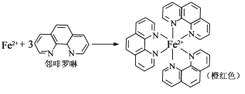
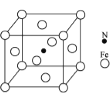
题目内容
【题目】在BaSO4饱和溶液中,加入Na2SO4(s),达到溶解平衡时,下列关系式正确的是( )
A. c(Ba2+)=c(SO42-)
B. c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)=Ksp(BaSO4)
C. c(Ba2+)=c(SO42-)=[Ksp(BaSO4)]1/2
D. c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)≠Ksp(BaSO4)
【答案】B
【解析】
常温下,在BaSO4饱和溶液中存在溶解平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq),向硫酸钡饱和溶液中加入Na2SO4固体,Na2SO4电离出SO42-而抑制BaSO4溶解,结合电荷守恒分析解答。
Ba2+(aq)+SO42-(aq),向硫酸钡饱和溶液中加入Na2SO4固体,Na2SO4电离出SO42-而抑制BaSO4溶解,结合电荷守恒分析解答。
A.常温下,在BaSO4饱和溶液中存在溶解平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq),故c(Ba2+)=c(SO42-)且c(Ba2+)·c(SO42-)=Ksp(BaSO4),向硫酸钡饱和溶液中加入Na2SO4固体,Na2SO4电离出SO42-使c(SO42-)增大,溶解平衡逆向移动,使c(Ba2+)减小,所以c(Ba2+)<c(SO42-),故A错误;
Ba2+(aq)+SO42-(aq),故c(Ba2+)=c(SO42-)且c(Ba2+)·c(SO42-)=Ksp(BaSO4),向硫酸钡饱和溶液中加入Na2SO4固体,Na2SO4电离出SO42-使c(SO42-)增大,溶解平衡逆向移动,使c(Ba2+)减小,所以c(Ba2+)<c(SO42-),故A错误;
B.根据A知,c(Ba2+)<c(SO42-),所以c(Ba2+)≠cSO42-),溶度积是温度的常数,故达到平衡时溶度积不变,故硫酸钡溶度积常数KSP(BaSO4)=c(Ba2+)c(SO42-),故B正确;
C.根据A知,加入硫酸钠溶液钡离子浓度和硫酸根离子浓度不再相等,所以c(Ba2+)≠cSO42-)故C错误;
D.根据B知,存在c(Ba2+)≠cSO42-),溶度积是温度的常数,故达到平衡时溶度积不变,故硫酸钡溶度积常数KSP(BaSO4)=c(Ba2+)c(SO42-),故D错误。
故选B。