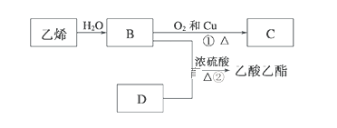
题目内容
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,受热易分解。亚氯酸钠制备及部分性质实验如图:
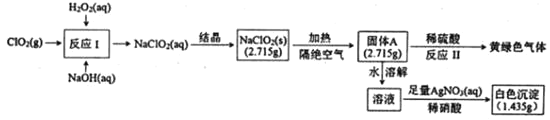
已知:①固体A为两种含氯盐组成的混合物:②AgClO3和AgcClO4都溶于水。
请回答:
(1)双氧水的电子式为___,固体A的成分是___(用化学式表示)。
(2)反应I的离子方程式为___。
(3)反应Ⅱ的化学方程式为___。
【答案】![]() NaCl、NaClO3 2ClO2+H2O2+2OH﹣=2ClO2﹣+O2↑+2H2O NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O
NaCl、NaClO3 2ClO2+H2O2+2OH﹣=2ClO2﹣+O2↑+2H2O NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O
【解析】
由实验可知,反应I中发生2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,然后结晶得到NaClO2(s),NaClO2隔绝空气加热可分解为NaClO3和NaCl,反应II中发生NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O,溶液与硝酸银反应生成的白色沉淀为AgCl。
(1)双氧水中氧原子最外层6个价电子,与另一个氧原子形成一对共用电子对,还有一个单电子与氢原子形成一个共用电子对,双氧水的结构式为H﹣O﹣O﹣H,电子式为![]() ,由流程图:NaClO2隔绝空气加热可分解为NaClO3和NaCl,固体A为两种含氯盐组成的混合物,固体A为NaCl、NaClO3;
,由流程图:NaClO2隔绝空气加热可分解为NaClO3和NaCl,固体A为两种含氯盐组成的混合物,固体A为NaCl、NaClO3;
(2)反应I的离子方程式为2ClO2+H2O2+2OH﹣=2ClO2﹣+O2↑+2H2O;
(3)反应Ⅱ的化学方程式为NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O。

练习册系列答案
相关题目