题目内容
4.下列叙述正确的是( )| A. | 含1molNa2S的溶液,最多可吸收2molSO2 | |
| B. | 可以用浓硫酸除去镀在铝表面的铜镀层 | |
| C. | Li、C、S分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
分析 A、可以分两步考虑,第一步,发生复分解反应,由于亚硫酸酸性比氢硫酸强,发生Na2S+2H2O+2SO2=2NaHSO3+H2S(既然是最多,就应该变为酸式盐),第二步,发生氧化还原反应:2H2S+SO2=3S+2H2O,据此计算分析;
B、常温下,Cu与浓硫酸不反应;
C、Li、C、P分别在足量氧气中燃烧分别得到氧化锂、二氧化碳、五氧化二磷;
D、Na2CO3受热不分解.
解答 解:A、可以分两步考虑,第一步,发生复分解反应,由于亚硫酸酸性比氢硫酸强,发生Na2S+2H2O+2SO2=2NaHSO3+H2S(既然是最多,就应该变为酸式盐),此步消耗二氧化硫2n mol;第二步,发生氧化还原反应:2H2S+SO2=3S+2H2O,此步消耗二氧化硫0.5n mol,共2.5n mol,故A错误;
B、常温下,Cu与浓硫酸不反应,所以不能用浓硫酸除去铝表面的铜镀层,故B错误;
C、Li、C、P分别在足量氧气中燃烧分别得到氧化锂、二氧化碳、五氧化二磷,均生成一种相应氧化物,故C正确;
D、Na2CO3受热不分解,无气体生成,故D错误;
故选C.
点评 本题考查了物质性质的分析判断,注意物质特殊性质的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.甲、乙两个烧杯各盛有l00mLlmol/L的盐酸和硫酸溶液,向两个烧杯中分别加入等质量的铁粉,反应后测得生成的气体体积比为2:3(均为相同状况下数据),则所加入的铁粉的质量为( )
| A. | 2.8g | B. | 3.36g | C. | 4.2g | D. | 5.6g |
15.有一种磷的结构式是 ,有关它的下列叙述不正确的是( )
,有关它的下列叙述不正确的是( )
 ,有关它的下列叙述不正确的是( )
,有关它的下列叙述不正确的是( )| A. | 它完全燃烧时的产物是P2O5 | B. | 它不溶于水 | ||
| C. | 它在常温下呈固态 | D. | 它与白磷互为同分异构体 |
19.常温下,下列各组离子中,在给定条件下一定能够大量共存的是( )
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | 滴加紫色石蕊溶液显红色的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、SO42-、NO3- |
13.下列说法正确的是( )
| A. | SiH4比CH4稳定 | |
| B. | O2- 半径比F- 的小 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | P和S属于第三周期的元素,H3PO4酸性比H2SO4的弱 |
14.下列过程发生了物理变化的是( )
| A. | 碘的萃取 | B. | 电解食盐水 | C. | 葡萄酿酒 | D. | 金属冶炼 |
 和
和 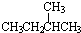 ②
② 和
和 
 与
与