题目内容
12.常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:①M的焰色反应呈黄色.
②五种盐均溶于水,水溶液均为无色.
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性.
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀.
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失.
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀.
请回答下列问题:
(1)五种盐中,所含阴离子相同的两种盐的化学式是(NH4)2SO4、Al2(SO4)3
(2)M溶液显碱性的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-
(3)X和Z的溶液反应的离子方程式是Ag++Cl-═AgCl↓
(4)N和氨水反应的离子方程式是Al3++3NH3•H2O═Al(OH)3↓+3NH4+
(5)若要检验Y中所含的阳离子,正确的实验方法是取少量Y于试管中,滴加少量NaOH溶液,在试管口附近放一张湿润的红色石蕊试纸,加热,若试纸变蓝,说明B中阳离子为NH4+.
分析 ①M的焰色反应呈黄色,则M中含Na+;
②五种盐均溶于水,水溶液均为无色,则没有Cu2+、Fe3+;
③X的溶液呈中性,Y、Z、N的溶液呈酸性则含有NH4+、Al3+、Ag+,M的溶液呈碱性,则含有CO32-,根据阳离子可知M为Na2CO3;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀,则X、Z中没有SO42-,也没有CO32-;
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失,说明Z中为Ag+,则N中有Al3+,所以Z中为AgNO3;
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀,则X为BaCl2,
由以上分析可知N中含有Al3+,Y中含有NH4+,加BaCl2均能生成不溶于稀硝酸的沉淀,则N、Y中含有SO42-,所以Y、N为(NH4)2SO4、Al2(SO4)3,以此来解答.
解答 解:①M的焰色反应呈黄色,则M中含Na+;
②五种盐均溶于水,水溶液均为无色,则没有Cu2+、Fe3+;
③X的溶液呈中性,Y、Z、N的溶液呈酸性则含有NH4+、Al3+、Ag+,M的溶液呈碱性,则含有CO32-,根据阳离子可知M为Na2CO3;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀,则X、Z中没有SO42-,也没有CO32-;
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失,说明Z中为Ag+,则N中有Al3+,所以Z中为AgNO3;
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀,则X为BaCl2,
由以上分析可知N中含有Al3+,Y中含有NH4+,加BaCl2均能生成不溶于稀硝酸的沉淀,则N、Y中含有SO42-,所以Y、N为(NH4)2SO4、Al2(SO4)3,
(1)所含阴离子相同的两种盐的化学式是(NH4)2SO4、Al2(SO4)3,故答案为:(NH4)2SO4、Al2(SO4)3;
(2)M的化学式为Na2CO3,Na2CO3溶液显碱性的原因是CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
(3)X和Z的溶液反应的离子反应为Ag++Cl-═AgCl↓,故答案为:Ag++Cl-═AgCl↓;
(4)Al2(SO4)3和氨水反应的离子方程式是Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(5)检验(NH4)2SO4中所含的阳离子的方法为:取少量(NH4)2SO4于试管中,滴加少量NaOH溶液,在试管口附近放一张湿润的红色石蕊试纸,加热,若试纸变蓝,说明B中阳离子为NH4+,
故答案为:取少量Y于试管中,滴加少量NaOH溶液,在试管口附近放一张湿润的红色石蕊试纸,加热,若试纸变蓝,说明B中阳离子为NH4+.
点评 本题考查物质的检验和推断,为高频考点,把握离子之间的反应及现象推断物质为解答的关键,综合考查元素化合物知识及化学反应原理,综合性较强,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 石膏能使豆浆变成豆腐 | |
| B. | 明矾净水 | |
| C. | 花粉在水面上做布朗运动 | |
| D. | 太阳光照在弥漫灰尘的室内,可看到从窗口到地面出现一条光亮的通路 |
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)该温度下,该反应的化学平衡常数是0.053.
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol?1 | 412.5 | 348 | 612 | 436 |
计算上述反应的△H=125 kJ•mol-1.若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是60%.此时,该反应是否达到了平衡状态?是(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.
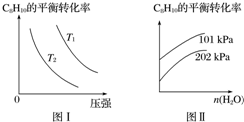
(4)由图Ⅰ可知,T1大于T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将越大(填“越大”、“越小”或“不变”),原因是水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大.
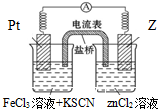 298K时,在FeCl3溶液中加少量锌粒后,Fe3+被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3溶液中加少量锌粒后,Fe3+被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A. | 正极电极反应为Zn-2e-═Zn2+ | |
| B. | 左边烧杯中溶液的红色变浅 | |
| C. | Pt电极上有气泡出现 | |
| D. | 该电池的总反应为:3Zn+2Fe3+═3Zn2++2 Fe |
| A. | 含1molNa2S的溶液,最多可吸收2molSO2 | |
| B. | 可以用浓硫酸除去镀在铝表面的铜镀层 | |
| C. | Li、C、S分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
| A. | 温度 | B. | 浓度 | C. | 催化剂 | D. | 反应物的性质 |
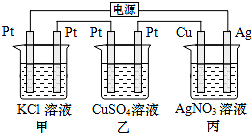
| A. | 标准状况下当甲中产生4.48 L气体时,丙中Cu电极质量增加21.6g | |
| B. | 电解过程中丙中溶液pH无变化 | |
| C. | 向甲中加入适量的盐酸,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-═Cu |
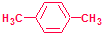 ,该烃在光照下生成的一氯代物在PMR谱中可能产生的各组信号峰的峰面积之比为3:2:2:2.
,该烃在光照下生成的一氯代物在PMR谱中可能产生的各组信号峰的峰面积之比为3:2:2:2.