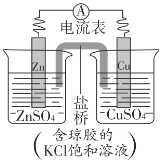
题目内容
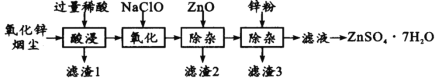
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用作木材的防腐剂等。用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2 O3、FeO等)生产ZnSO4·7H2O的流程如下:
有关金属离子[c(Mn+)= 0.l mol/L]形成氢氧化物沉淀的pH范围如下表:
金属离 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”时用的稀酸是____;滤渣1主要成分是____。
(2)“氧化”时的离子方程式为_________;加入ZnO除杂时溶液的pH控制范围是____~5.0。
(3)滤渣3含有锌和____;滤液得到ZnSO4·7H2O的操作是____、洗涤、干燥。
(4)取14.35gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 8. 95 | 8. 05 | 6. 72 | 4.05 |
则680℃时剩余固体的化学式为________(填序号)。
A.ZnO B.Zn3O(SO4
【答案】稀硫酸(或 H2SO4) PbSO4 2Fe2+ +ClO- +2H+=2Fe3++Cl-+H2O 2.8 铜(或 Cu) 蒸发浓缩, 冷却结晶, 过滤 B
【解析】
氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2O3、FeO等)加过量稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁、硫酸铁,硫酸铅不溶于水,形成滤渣1;过滤分离,滤液中加入次氯酸钠溶液,将亚铁离子氧化生成铁离子,然后加入ZnO调节溶液的pH,使铁离子形成氢氧化铁沉淀形成滤渣2,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣3为Cu(可能含有Zn),滤液为硫酸锌溶液,蒸发浓缩、冷却结晶、过滤得到ZnSO47H2O晶体,据此分析解答。
(1)“酸浸”时用的稀酸是稀硫酸;滤渣1主要成分是硫酸铅,故答案为:稀硫酸(或H2SO4);PbSO4;
(2)“氧化”时是将亚铁离子氧化生成铁离子,反应的离子方程式为2Fe2+ +ClO- +2H+=2Fe3++Cl-+H2O;加入ZnO是调节溶液的pH,使铁离子形成氢氧化铁沉淀,根据有关金属离子[c(Mn+)= 0.l mol/L]形成氢氧化物沉淀的pH范围数据,除杂时溶液的pH控制范围2.8~5.0,故答案为:2Fe2+ +ClO- +2H+=2Fe3++Cl-+H2O;2.8;
(3)根据上述分析,滤渣3含有锌和铜;滤液得到ZnSO4·7H2O的操作是蒸发浓缩,冷却结晶、过滤、洗涤、干燥,故答案为:铜(或 Cu);蒸发浓缩,冷却结晶、过滤;
(4)14.35gZnSO4·7H2O中含有Zn元素的质量为14.35g×![]() =3.25g;如果是ZnO,则ZnO的质量为3.25g×
=3.25g;如果是ZnO,则ZnO的质量为3.25g×![]() =4.05g,故A错误;如果是Zn3O(SO4)2,则Zn3O(SO4)2的质量为3.25g×
=4.05g,故A错误;如果是Zn3O(SO4)2,则Zn3O(SO4)2的质量为3.25g×![]() =6.72g,故B正确;如果是ZnSO4,则ZnSO4的质量为3.25g×
=6.72g,故B正确;如果是ZnSO4,则ZnSO4的质量为3.25g×![]() =8.05g,故C错误;如果是ZnSO4·H2O,则ZnSO4·H2O的质量为3.25g×
=8.05g,故C错误;如果是ZnSO4·H2O,则ZnSO4·H2O的质量为3.25g×![]() =8.95g,故D错误;故答案为:B。
=8.95g,故D错误;故答案为:B。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案【题目】下列操作对应的现象和离子方程式均正确的是( )
操作 | 现象 | 离子方程式 | |
A | 饱和碳酸钠溶液中通入过量CO2 | 无明显变化 | CO |
B | 向苏打溶液溶液中滴加稀硫酸 | 立即产生气泡 | CO |
C | 向Ba(OH)2溶液中加足量NaHCO3溶液 | 生成白色沉淀 | 2HCO |
D | 向NaHCO3溶液中加入少量偏铝酸钠 | 生成白色沉淀和无色气体 | HCO |
A.AB.BC.CD.D
【题目】直接排放含SO2的烟气会形成酸雨危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应原理为__。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式为__。
(3)吸收液吸收SO2的过程中,pH随n(![]() ):n(
):n(![]() )变化关系如表:
)变化关系如表:
n( | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显性__(填“酸”或“碱”),用化学平衡原理解释__。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(填字母编号)__。
a.c(Na+)=2c(![]() )+c(
)+c(![]() )
)
b.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
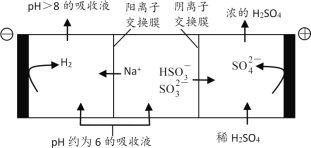
①![]() 在阳极放电的电极反应式是__。
在阳极放电的电极反应式是__。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理__。
【题目】已知某溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、![]() 、
、![]() 、
、![]() 、I-、
、I-、![]() 、
、![]() 中的若干种离子组成。某化学兴趣小组通过下列实验确定了其组成。
中的若干种离子组成。某化学兴趣小组通过下列实验确定了其组成。
(1)根据下列实验步骤和现象,推断实验结论:
实验步骤与实验现象 | 实验结论 |
Ⅰ.观察溶液:无色透明 | ①原溶液中一定不含的离子是____。 |
Ⅱ.取适量该溶液,加入过量的硝酸,有气体生成,并得到无色溶液 | ②原溶液中一定不含的离子是_____,一定含有的离子是____。 |
Ⅲ.在Ⅱ所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀A | ③原溶液中还一定含有的离子是____,生成沉淀A的离子方程式为____。 |
Ⅳ.在Ⅲ所得溶液中再逐滴加入氢氧化钡溶液至过量,加热也有气体生成,同时析出白色沉淀B | ④白色沉淀B中一定含有___,可能含有____。 |
(2)上述实验步骤Ⅳ中开始阶段一定发生的离子方程式是______。
(3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示。
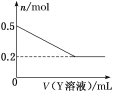
Y可能为(填化学式)____,B的组成为______。