题目内容
3.有X、Y、Z三种单质,X为金属单质,Y、Z为非金属单质,Y、Z通常情况下为气态,Y、Z一定条件下反应的产物溶于水可得无色溶液E,E能使紫色石蕊试液变红,X与E反应可生成Z和另一产物W,X、Y反应的产物F溶于水为棕黄色溶液,将Y通入W溶液也可得到F的溶液.(1)W的名称是氯化亚铁.
(2)若往w溶液中滴入NaOH溶液,可产生沉淀,此沉淀在空气中发生变化,现象是白色絮状沉淀迅速变为灰绿色,最终变为红褐色;化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)实验室制备Y的化学方程式为MnO2+4HCl $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
分析 Y、Z为非金属单质,且通常情况下为气态,Y、Z一定条件下反应的产物溶于水可得无色溶液E,E能使紫色石蕊试液变红,说明E的水溶液呈酸性,应是氢气与氯气反应生成HCl,即E为HCl,X为金属单质,X与E反应可生成Z和另一产物W,则Z应为H2,X、Y反应的产物F溶于水为棕黄色溶液,应生成氯化铁,则Y为Cl2,X为Fe,W为氯化亚铁,将氯气通入氯化亚铁溶液也可得到氯化铁的溶液,据此解答.
解答 解:Y、Z为非金属单质,且通常情况下为气态,Y、Z一定条件下反应的产物溶于水可得无色溶液E,E能使紫色石蕊试液变红,说明E的水溶液呈酸性,应是氢气与氯气反应生成HCl,即E为HCl,X为金属单质,X与E反应可生成Z和另一产物W,则Z应为H2,X、Y反应的产物F溶于水为棕黄色溶液,应生成氯化铁,则Y为Cl2,X为Fe,W为氯化亚铁,将氯气通入氯化亚铁溶液也可得到氯化铁的溶液.
(1)由以上分析可知W为氯化亚铁,故答案为:氯化亚铁;
(2)在氯化亚铁溶液中加入氢氧化钠,可生成白色絮状氢氧化亚铁沉淀,氢氧化亚铁不稳定,被空气氧气氧化生成氢氧化铜,可观察到:白色絮状沉淀迅速变为灰绿色,最终变为红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色絮状沉淀迅速变为灰绿色,最终变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)实验室制备氯气的反应方程式为:MnO2+4HCl $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
点评 本题考查无机物的推断,突破口为物质的颜色变化及物质状态,侧重于学生的分析能力的考查,注意把握物质的性质及其转化,难度中等.

| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该实验中一定没有添加KIO3 |
| D | 向苯酚钠溶液滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 由H+(aq)+OH-(aq)═H2O△H=-57.3 kJ/mol可知:含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| B. | 从C(石墨)═C(金刚石)△H=+1.19 kJ/mol可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多 | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol-1 |
| A. | 活性炭、吸附剂 | B. | KMnO4、氧化剂 | C. | 氯化钠、干燥剂 | D. | 硅胶、干燥剂 |
| A. | (NH4)2SO4溶液 | B. | MgCl2溶液 | C. | NaHCO3溶液 | D. | CuSO4溶液 |
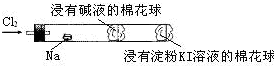 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| D. | 管右端浸有淀粉KI溶液的棉球颜色变化可判断氯气是否被碱液完全吸收 |
| A. | 饱和氯水中Cl-、NO3-、Na+、SO32-可以大量存在 | |
| B. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| C. | 向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色,说明原溶液中有I- | |
| D. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO32-+2I-+4H+ |
| A. | 乙醇和乙酸制乙酸乙酯;苯的硝化反应 | |
| B. | 乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷 | |
| C. | 葡萄糖与新制氢氧化铜共热;蔗糖与稀硫酸共热 | |
| D. | 乙醇和氧气制乙醛;苯和氢气制环己烷 |
 羟基
羟基 羰基
羰基 酯基
酯基 醛基
醛基 羧基.
羧基.