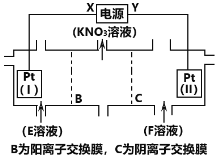
题目内容
【题目】镁在航空航天、国防工业等领域有广泛应用。某小组利用某工厂废弃物(主要含MgCO3、MgSiO3、Al2O3和Fe2O3)设计回收镁的工艺流程如下:
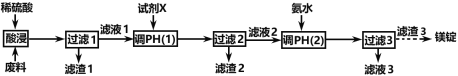
(1)酸浸过程中采用“粉碎废料、加热和搅拌、适当提高稀硫酸的浓度”等措施的目的是_________________________。
为了提高产品纯度,试剂X宜选择(________________)(填代号)。
A.CuO B.MgO C.MgCO3 D.氨水
(2)滤渣1的主要成分是____________:滤渣2的主要成分是____________(填化学式)。
(3)写出生成滤渣3的离子方程式_____________________。
(4)已知:298K,时,Ksp[Al(OH)3]=3.0 × 10-34, Ksp[Fe(OH)3]=4.0 × 10-38,加入试剂X,当Al3+开始沉淀时,溶液中c(Al3+)∕c(Fe3+)=________________。
(5)若废料中镁元素的质量分数为a% ,利用mkg这种废料按上述流程生产,最终回收到质量分数为b%的镁锭wkg,则它的产率为________% 。
(6)参照海水提镁的某些步骤和上述流程图,设计经三步由滤渣3得到镁锭的路线____________。
【答案】提高酸浸速率 BCD H2SiO3 Fe(OH)3、Al(OH)3 Mg2+ + 2NH3H2O = Mg(OH)2↓ + 2NH4+ 7500 100wb∕am 
【解析】
废弃物(主要含MgCO3、MgSiO3、Al2O3和Fe2O3)中加入稀硫酸,反应生成硫酸镁、硫酸铝和硫酸铁,以及二氧化碳和硅酸沉淀,因此过滤后的滤渣1为硅酸沉淀,滤液热中含有硫酸镁、硫酸铝和硫酸铁,根据实验目的,需要除去铁离子和铝离子,因此滤渣3为氢氧化镁,滤液2中含有镁离子,则加入试剂X可以除去铁离子和铝离子,滤渣2中含有Fe(OH)3、Al(OH)3,据此分析解答。
(1) 废弃物(主要含MgCO3、MgSiO3、Al2O3和Fe2O3)中加入稀硫酸,反应生成硫酸镁、硫酸铝和硫酸铁,以及二氧化碳和硅酸沉淀,酸浸过程中采用“粉碎废料、加热和搅拌、适当提高稀硫酸的浓度”等措施可以提高酸浸速率;为了提高产品纯度,不能引入新的杂质金属阳离子,因此试剂X可以选择MgO、MgCO3、氨水,通过可知pH值,除去铁离子和铝离子,故答案为:提高酸浸速率;BCD;
(2)根据上述分析,滤渣1的主要成分是H2SiO3,滤渣2的主要成分是Fe(OH)3、Al(OH)3,故答案为:H2SiO3;Fe(OH)3、Al(OH)3;
(3) 滤渣3为氢氧化镁,生成滤渣3的离子方程式为Mg2+ + 2NH3H2O = Mg(OH)2↓ + 2NH4+,故答案为:Mg2+ + 2NH3H2O = Mg(OH)2↓ + 2NH4+;
(4) 298K时,Ksp[Al(OH)3]=3.0 × 10-34, Ksp[Fe(OH)3]=4.0 × 10-38,当Al3+开始沉淀时,溶液中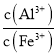 =
=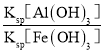 =
=![]() =7500,故答案为:7500;
=7500,故答案为:7500;
(5) mkg这种废料中含有的镁元素的质量为mkg ×a%,质量分数为b%的wkg镁锭中含有镁元素的质量为wkg×b%,则产率=![]() ×100%=
×100%=![]() %,故答案为:
%,故答案为:![]() ;
;
(6)滤渣3为氢氧化镁,可以用足量的盐酸溶解后得到氯化镁溶液,再在氯化氢气氛中蒸发得到氯化镁晶体,最终电解熔融的氯化镁得到镁,因此得到镁锭的路线为![]() ,故答案为:
,故答案为:![]() 。
。

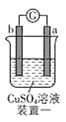
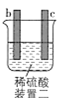
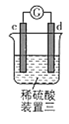
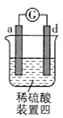
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【题目】已知反应2CH3OH(g)=CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
(1)比较此时正、逆反应速率的大小:v(正)____v(逆)(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10min反应达到平衡,此时CH3OH的转化率__ ,该时间内反应速率v(CH3OH)=____ mol·L-1·min-1。