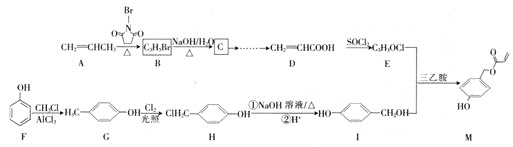
题目内容
【题目】“电化学”与人类生产和生活密不可分。
(1)如图为相互串联的甲、乙两个电解池,试回答下列问题。

①乙池中若滴入少量酚酞,开始一段时间后,_____电极附近呈红色(填“铁”或“碳”)。
②甲池若为用电解原理精炼铜的装置,A极电极反应式为_____。
③甲池若为用电解原理精炼铜的装置,阴极增重12.8g时,则乙池阳极放出气体在标准状况下的体积为_____(不考虑气体溶解情况)。
(2)人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。

①阳极反应生成的氯气将尿素氧化而得以除去,试写出该反应的化学方程式_____。
②若两极共收集到气体13.44L(标况),则除去的尿素质量为_____ g(忽略气体的溶解)。
【答案】铁 Cu2++2e-=Cu 4.48L CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl 7.2g
【解析】
(1)据图可知甲池中A电极与电源负极相连为阴极,发生还原反应,B电极为阳极, 氧化反应;乙池中Fe电极为阴极,水电离出的氢离放电生成氢气,同时产生氢氧根,C电极为阳极,氯离子放电生成氯气。
(2)据图可知装置左侧有Cl2产生,即氯离子被氧化,所以左侧为阳极,右侧为阴极;阳极产生的氯气再和尿素反应生成CO2和N2。
(1)①Fe电极为阴极,水电离出的氢离子放电生成氢气,同时电离出更多的氢氧根,使电极负极显碱性,即铁电极负极呈红色;
②甲池若为用电解原理精炼铜的装置,A电极为阴极,铜离子放电,电极方程式为Cu2++2e-=Cu;
③电解精炼铜时,阴极发生Cu2++2e-=Cu,当生产12.8gCu即0.2molCu时转移的电子为0.4mol,乙池阳极发生2Cl--2e-=Cl2,转移0.4mol电子时可产生0.2mol氯气,标况下体积为4.48L;
(2)①反应物有[CO(NH2)2]和Cl2,产物有CO2和N2、NaCl,根据化合价变化可知该过程中氯气将N元素氧化,结合电子守恒和元素守恒可得方程式为:CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
②阴极反应为6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑),阳极反应为6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,根据方程式可知相同时间内阴极产生的气体的物质的量与阳极产生气体的物质的量之比为3:2;若两极共收集到气体13.44L(标准状况),混合气体物质的量=![]() =0.6mol,则n(N2)=n(CO2)=0.6mol×
=0.6mol,则n(N2)=n(CO2)=0.6mol×![]() =0.12 mol,根据N原子守恒得n[CO(NH2)2]=n(N2)=0.12mol,尿素质量m=nM=0.12mol×60g/mol=7.2g。
=0.12 mol,根据N原子守恒得n[CO(NH2)2]=n(N2)=0.12mol,尿素质量m=nM=0.12mol×60g/mol=7.2g。

【题目】已知反应2CH3OH(g)=CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
(1)比较此时正、逆反应速率的大小:v(正)____v(逆)(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10min反应达到平衡,此时CH3OH的转化率__ ,该时间内反应速率v(CH3OH)=____ mol·L-1·min-1。