题目内容
16.BF3与BCl3分子的空间构型均为平面正三角形,下列有关二者的比较中,正确的是( )| A. | 分子中各原子最外层都满足8电子稳定结构 | |
| B. | 键角均为60°,都是含有极性键的极性分子 | |
| C. | BF3沸点低于BCl3沸点,因为B-F键键长短 | |
| D. | BF3分子稳定性高于BCl3,因为B-F键键能高 |
分析 A.BF3与BCl3分子中B的最外层只有6个电子;
B.键角为120°,结构对称;
C.结构相似的分子,其相对分子质量越大,熔沸点越高;
D.原子半径越小,共价键的键能越大,分子越稳定.
解答 解:A.BF3与BCl3分子中B的最外层只有6个电子,则B原子不满足8电子稳定结构,故A错误;
B.BF3与BCl3分子的空间构型均为平面正三角形,键角为120°,结构对称,为非极性分子,故B错误;
C.结构相似的分子,其相对分子质量越大,熔沸点越高,BF3沸点低于BCl3沸点,是因为BF3的相对分子质量小,与共价键的键长无关,故C错误;
D.原子半径越小,共价键的键能越大,分子越稳定,F原子半径小于Cl原子,所以B-F键键能高,BF3分子稳定性高于BCl3,故D正确.
故选D.
点评 本题考查了分子的构型、键能、键角、分子稳定性、沸点等内容,侧重于基础知识的应用的考查,题目难度不大,注意分子晶体熔沸点的比较方法.

练习册系列答案
相关题目
6.下列物质不属于高分子化合物的是( )
| A. | 纤维素 | B. | 蛋白质 | C. | 淀粉 | D. | 蔗糖 |
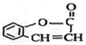
1.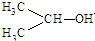 可简写为
可简写为 .达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(
.达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(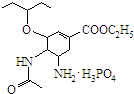 ),有关它的说法错误的是( )
),有关它的说法错误的是( )
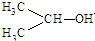 可简写为
可简写为 .达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(
.达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图( ),有关它的说法错误的是( )
),有关它的说法错误的是( )| A. | 达菲是一种磷酸盐 | |
| B. | 达菲分子中含有肽键 | |
| C. | 达菲的分子式为C16H31N2O8P | |
| D. | 1mol达菲可与2mol H2发生加成反应 |
5.常温下能用铁制或铝制容器盛放的是( )
| A. | 稀硝酸、稀硫酸 | B. | 硝酸银溶液 | C. | 浓硝酸、浓硫酸 | D. | 硫酸铜溶液 |
 ;
;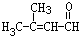 .
.
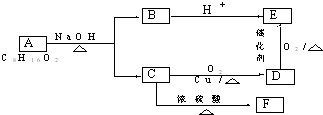
 .
.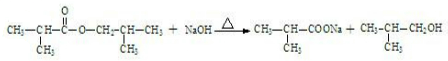 .
.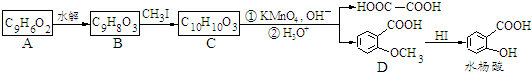
 .
.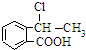 合成
合成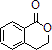 ,写出相关化学反应方程式
,写出相关化学反应方程式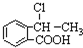 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$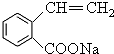 +H2O+NaCl、
+H2O+NaCl、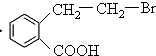 、
、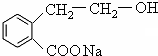 ++NaBr+H2O、2
++NaBr+H2O、2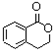 +2H2O+Na2SO4.
+2H2O+Na2SO4.