题目内容
14.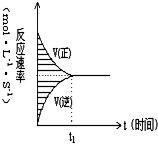 在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )
在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )| A. | X的浓度的减少 | B. | Y的物质的量的减少 | ||
| C. | Y的浓度的减少 | D. | X的物质的量的减少 |
分析 由v=$\frac{△c}{△t}$可知,v正与t的乘积为浓度减小量,v逆与t的乘积为浓度增加量,以此分析图中阴影部分的面积;
解答 解:由v=$\frac{△c}{△t}$可知,v正与t的乘积为浓度减小量,v逆与t的乘积为浓度增加量,所以阴影部分的面积为正反应Y的浓度减少与逆反应Y的浓度增加的差,
即为Y浓度的减少,也等于Z浓度的增加,为X浓度减少的2倍,
故选C.
点评 本题考查图象和反应速率,明确速率与时间的乘积是解答本题的关键,注意把握反应中各物质的量之比的关系,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是( )


| A. | 装置出口①处的物质是氯气 | |
| B. | 出口②处的物质是氢气,该离子交换膜只能让阳离子通过 | |
| C. | 装置中发生的反应的离子方程式2Cl-+2H+$\stackrel{通电}{→}$Cl2↑+H2↑ | |
| D. | 该装置是将电能转化为化学能 |
9.下列物质一定属于同系物的是( )
① ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6
④C2H4⑤CH2═CH-CH═CH2⑥C3H6
⑦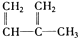 ⑧
⑧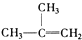
①
 ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
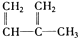 ⑧
⑧
| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ④、⑥和⑧ |
6.1L A气体与0.5L B气体反应,恢复原温度和压强时,生成气体的体积为1L,已知生成物的化学式为X2Y,则A的分子式为( )
| A. | XY2 | B. | X3Y | C. | X2 | D. | Y2 |
3.“纳米材料”是指直径从几纳米至几十纳米的材料,目前已广泛应用于催化剂及军事技术中,如果将纳米材料分散到液体分散剂中,所得混合物( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸.
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸.
| A. | ①④⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③④ |
4.通过量CO2于下列溶液中,出现浑浊的是( )
| A. | Ba(NO3)2溶液 | B. | 饱和澄清石灰水 | C. | Na2SO4溶液 | D. | 饱和Na2CO3溶液 |