题目内容
4.如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是( )
| A. | 装置出口①处的物质是氯气 | |
| B. | 出口②处的物质是氢气,该离子交换膜只能让阳离子通过 | |
| C. | 装置中发生的反应的离子方程式2Cl-+2H+$\stackrel{通电}{→}$Cl2↑+H2↑ | |
| D. | 该装置是将电能转化为化学能 |
分析 A、出口①是电解池的阳极;
B、依据装置图可知,出口②是电解池的阴极,离子交换膜是阳离子交换膜;
C、装置是电解饱和食盐水,电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气;
D、装置是电极原理是电能转化为化学能.
解答 解:A、根据钠离子移向阴极确定②是阴极,出口①是电解池的阳极,溶液中的氯离子在阳极失电子生成氯气,故A正确;
B、根据钠离子移向阴极确定②是阴极,出口②是电解池的阴极,溶液中的氢离子得到电子发生还原反应生成氢气,离子交换膜是阳离子交换膜,只允许阳离子通过,不能让阴离子通过,故B正确;
C、装置是电解饱和食盐水,电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;故C错误;
D、装置是电解原理是电能转化为化学能的装置,故D正确;
故选:C.
点评 本题考查了电解原理的分析应用,电极判断,电极反应分析,掌握电解原理是解题关键,题目难度中等.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
14.下列条件下,两种气体的分子数一定不相等的是( )
| A. | 相同体积、相同密度的CO和C2H4 | |
| B. | 相同质量、不同密度的N2和C2H4 | |
| C. | 相同压强、相同体积、相同质量的O2和N2 | |
| D. | 相同温度、相同压强、相同体积的O2和N2 |
12.下列分子中属于非极性分子的是( )
| A. | HF | B. | H2O2 | C. | CO2 | D. | NH3 |
19.设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
| A. | 0.2 mol/L的Ba(NO3)2溶液1 L,含NO3-数为0.2NA | |
| B. | 常温常压下,22.4L氧气所含的原子数为2NA | |
| C. | 常温常压下,48gO2、O3组成的混合气体所含的氧原子数为3NA | |
| D. | 1L0.1 mol/LNaCl溶液中所含的Na+ 的电子数为1.1NA |
9.下列有关检验碳酸钠样品中是否含有氯化钠杂质的实验方案中,最合理的是( )
| A. | 取少量样品于试管中,加入适量蒸馏水溶解,滴加几滴AgNO3溶液,若产生白色沉淀,说明样品中含有氯化钠杂质 | |
| B. | 取少量样品于试管中,加入适量蒸馏水溶解,再加入足量盐酸至不再产生气泡,然后滴加几滴AgNO3溶液,若产生白色沉淀,说明样品中含有氯化钠杂质 | |
| C. | 取少量样品于试管中,加入适量蒸馏水溶解,再加入足量硫酸至不再产生气泡,然后滴加几滴AgNO3溶液,若产生白色沉淀,说明样品中含有氯化钠杂质 | |
| D. | 取少量样品于试管中,加入适量蒸馏水溶解,再加入足量硝酸至不再产生气泡,然后滴加几滴AgNO3溶液,若产生白色沉淀,说明样品中含有氯化钠杂质 |
16.恒温条件下,将NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g),△H<0达到平衡后,慢慢压缩气体体积,下列叙述正确的是( )
| A. | 若体积减小一半,则压强为原来的两倍 | |
| B. | 平衡向右移动,混合气体颜色一定会变浅 | |
| C. | 若体积减小一半,压强增大,达到原来的两倍 | |
| D. | 平衡向右移动,混合气体密度增大 |
14.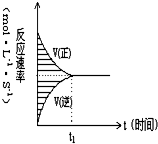 在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )
在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )
 在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )
在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )| A. | X的浓度的减少 | B. | Y的物质的量的减少 | ||
| C. | Y的浓度的减少 | D. | X的物质的量的减少 |