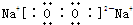题目内容
19.填写下列空白:(1)1mol H2O中约含有NA个H2O、2NA个H、NA个O、2mol H、1 mol O.
(2)含有6.02×1023个H的H2O,其物质的量是0.5mol;1 mol Na2SO4溶于水能电离出2NA个Na+、NA个SO42-
(3)3mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等.
(4)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为17:16.
(5)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为4:3.
(6)一个典型病毒微粒的直径是5×10-6cm,如果把阿伏加德罗常数个这种病毒排成一行,其长度是3.01×1018cm.
分析 (1)1mol水中含NA个水分子;根据水由2个氢原子、1个氧原子构成来分析;
(2)根据物质的量n=$\frac{N}{{N}_{A}}$来计算;1 mol Na2SO4中含2mol钠离子和1mol硫酸根;
(3)1.5 mol CO2中含3mol氧原子,而1mol水中含1mol氧原子;
(4)物质的量相等时,质量之比等于摩尔质量之比;
(5)NH3与CH4中氢原子个数之比为3:4;
(6)根据总长度等于粒子个数乘以粒子直径计算.
解答 解:(1)1mol水中含NA个水分子,由于水由2个氢原子、1个氧原子构成,故1mol水中含2molH原子、1molO原子,即含2NA个H原子和NA个O原子,故答案为:NA,2NA,NA,2,1;
(2)6.02×1023个H的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}}$=1mol,由于1mol水中含2mol氢原子,故含1mol氢原子的水的物质的量为0.5mol;1 mol Na2SO4中含2mol钠离子和1mol硫酸根,故1 mol Na2SO4溶于水能电离出2NA个氢离子和NA个硫酸根,故答案为:0.5mol;2NA;NA;
(3)1.5 mol CO2中含3mol氧原子,而1mol水中含1mol氧原子,故要想和1.5 mol CO2中含有的氧原子数相同,需要水的物质的量为3mol,故答案为:3;
(4)物质的量相等时,质量之比等于摩尔质量之比,故等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比等于17:16,故答案为:17:16;
(5)NH3与CH4中氢原子个数之比为3:4,故要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为4:3,故答案为:4:3;
(6)长度为:5×10-6cm×6.02×1023=3.01×1018cm,故答案为:3.01×1018.
点评 本题考查阿伏加德罗常数、摩尔质量以及相对原子质量的计算,题目难度不大,注意有关计算公式的运用.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案| A. | 取少量样品于试管中,加入适量蒸馏水溶解,滴加几滴AgNO3溶液,若产生白色沉淀,说明样品中含有氯化钠杂质 | |
| B. | 取少量样品于试管中,加入适量蒸馏水溶解,再加入足量盐酸至不再产生气泡,然后滴加几滴AgNO3溶液,若产生白色沉淀,说明样品中含有氯化钠杂质 | |
| C. | 取少量样品于试管中,加入适量蒸馏水溶解,再加入足量硫酸至不再产生气泡,然后滴加几滴AgNO3溶液,若产生白色沉淀,说明样品中含有氯化钠杂质 | |
| D. | 取少量样品于试管中,加入适量蒸馏水溶解,再加入足量硝酸至不再产生气泡,然后滴加几滴AgNO3溶液,若产生白色沉淀,说明样品中含有氯化钠杂质 |
| A. | 蒸发皿 | B. | 烧杯 | C. | 锥形瓶 | D. | 蒸馏烧瓶 |
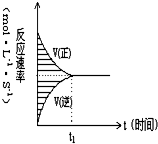 在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )
在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )| A. | X的浓度的减少 | B. | Y的物质的量的减少 | ||
| C. | Y的浓度的减少 | D. | X的物质的量的减少 |
| A. |  制备Fe(OH)2 | B. |  实验室制备乙炔 | ||
| C. |  从碘与NaCl混合液中分离出碘 | D. |  比较白磷、红磷的着火点 |
| A. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 |

 .
.