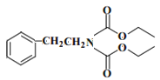
题目内容
【题目】实验室可用苯乙酮间接电氧化法合成苯甲酸,原理如图所示:
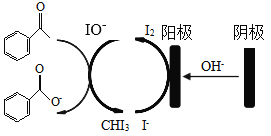
实验步骤如下:
步骤I:电合成:在电解池中加入KI、20mL蒸馏水和20mL的1,4-二氧六环,搅拌至完全溶解,再加入20mL苯乙酮,连接电化学装置,恒定电压下电解7h;
步骤II:清洗分离:反应停止后,将反应液转移至烧瓶,蒸馏除去反应溶剂;用蒸馏水和二氯甲烷洗涤烧瓶,将洗涤液转移至分液漏斗;用二氯甲烷萃取除去质,分离出水相和有机相;
步骤III:制得产品:用浓盐酸酸化水相至pH为1~2,接着加入饱和NaHSO3溶液,振荡、抽滤、干燥,称量得到产品7.8g;
有关物质的数据如下表所示:
物质 | 分子式 | 溶解性 | 沸点(℃) | 密度(g/cm3) | 相对分子质量 |
苯乙酮 | C8H8O | 难溶于水 | 202.3 | 1.03 | 120 |
苯甲酸 | C7H6O2 | 微溶于水 | 249 | 1.27 | 122 |
二氯甲烷 | CH2Cl2 | 不溶于水 | 40 | 1.33 | 85 |
回答下列问题:
(1)步骤I中,阴极的电极反应式为________________________ ,苯乙酮被氧化的离子方程式为_____________________
(2)步骤II蒸馏过程中,需要使用到的玻璃仪器有____________,(填标号)除此之外还需要____________________
(3)步骤II分液过程中,应充分振荡,静置分层后________(填标号)
A.直接将有机相从分液漏斗的上口倒出
B.直接将有机相从分液漏斗的下口放出
C.先将有机相从分液漏斗的下口放出,再将水相从下口放出
D.先将有机相从分液漏斗的下口放出,再将水相从上口倒出
(4)步骤III中,加入浓盐酸的目的是____________________
(5)步骤III中,加入饱和NaHSO3溶液,水相中的颜色明显变浅,说明过量的I2被还原为I-,其离子方程式为_______________________
(6)本实验的产率是______________(保留小数后一位有效数字)
(7)得到的粗苯甲酸可用____________法进行提纯。
【答案】H2O+2e-=== H2↑+2OH- ![]() + 3IO- =
+ 3IO- = ![]() + CHI3 + 2OH- a、c、d、e、g (直形)冷凝管 D 将苯甲酸盐转化为苯甲酸 HSO3-+I2+H2O=SO42-+3H++2I- 37.6% 重结晶法
+ CHI3 + 2OH- a、c、d、e、g (直形)冷凝管 D 将苯甲酸盐转化为苯甲酸 HSO3-+I2+H2O=SO42-+3H++2I- 37.6% 重结晶法
【解析】
(1)步骤I中,阴极水得电子放出氢气,苯乙酮被IO3-氧化为![]() 和CHI3;
和CHI3;
(2)根据蒸馏装置分析仪器;
(3)分液操作,下层液体从下口流出,上层液体从上口倒出;
(4) 根据强酸制弱酸回答;
(5) HSO3-被I2氧化为SO42-;
(6)产率=实际产量÷理论产量×100%;
(7)根据苯甲酸的溶解性分析提纯方法。
(1)步骤I中,阴极水得电子放出氢气,阴极反应式是H2O+2e-=== H2↑+2OH-,苯乙酮被IO3-氧化为![]() 和CHI3,反应的离子方程式为
和CHI3,反应的离子方程式为![]() + 3IO-=
+ 3IO-=![]() + CHI3 + 2OH-;
+ CHI3 + 2OH-;
(2)根据蒸馏装置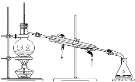 ,需要使用到的玻璃仪器有a、c、d、e、g,除此之外还需要(直形)冷凝管;
,需要使用到的玻璃仪器有a、c、d、e、g,除此之外还需要(直形)冷凝管;
(3)二氯甲烷的密度大于水,有机相在下层,先将有机相从分液漏斗的下口放出,再将水相从上口倒出,故选D;
(4) 水相中含有苯甲酸盐,加入浓盐酸,苯甲酸盐和浓盐酸反应生成弱酸苯甲酸,所以步骤III中,加入浓盐酸的目的是将苯甲酸盐转化为苯甲酸;
(5)步骤III中,加入饱和NaHSO3溶液,水相中的颜色明显变浅,说明过量的I2被还原为I-,HSO3-被I2氧化为SO42-,其离子方程式为HSO3-+I2+H2O=SO42-+3H++2I-;
(6) 根据![]() + 3IO-=
+ 3IO-=![]() + CHI3 + 2OH-,1mol苯乙酮生成1mol苯甲酸,20mL苯乙酮的质量是20mL×1.03=20.6g,苯乙酮的物质的量是0.17mol,理论上生成苯甲酸的物质的量是0.17mol,质量是0.17mo×122g/mol=20.74g,产率=7.8÷20.74×100%=37.6%;
+ CHI3 + 2OH-,1mol苯乙酮生成1mol苯甲酸,20mL苯乙酮的质量是20mL×1.03=20.6g,苯乙酮的物质的量是0.17mol,理论上生成苯甲酸的物质的量是0.17mol,质量是0.17mo×122g/mol=20.74g,产率=7.8÷20.74×100%=37.6%;
(7)苯甲酸微溶于水,用重结晶法提纯苯甲酸。

【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Ni、Fe、Al2O3、CaO、炭及有机物等)制取CoC2O4的工艺流程如下:
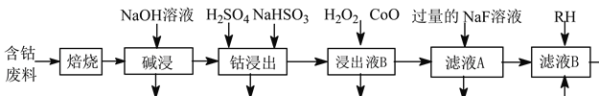
己知:①草酸钴晶体难溶于水
②RH为有机物,可用RH、有机溶剂萃取出溶液中的Ni2+
③几种金属阳离子的氢氧化物沉淀时的PH如表所示:
Fe3+ | Co2+ | |
开始沉淀时 | 1.9 | 7.1 |
沉淀完全时 | 3.7 | 9.1 |
(1)“焙烧”的目的_______。
(2)“碱浸”过程中Al2O3发生反应的化学方程式为_______。
(3) 经硫酸酸化后,“钴浸出”过程中Co3+转化为Co2+的离子方程式为_______。
(4)“浸出液B”中加入CoO并调节pH值至3.7~7.1的目的为_______。
(5) 加入NaF溶液可将钙离子转化为沉淀并过滤除去,若所得滤液中c(F-)=1.0×10-2mol·L1,则滤液中c(Ca2+)为_______mol·L1[已知Ksp(CaF2)=1.05×10-10]。
(6) 萃取后水层中含有大量的Co2+,将水层与酸性KMnO4溶液充分混合生成Co3+、Mn2+,理论上完全反应消耗的n(Co2+)∶n(MnO4-)=_______。