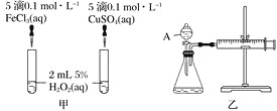
题目内容
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在水电离出的H+浓度为1.0×10-13mol·L-1:Na+、K+、![]() 、
、![]()
B.使甲基橙呈红色的溶液中,可能大量存在的是:![]() ,K+、ClO、
,K+、ClO、![]()
C.某无色溶液中可能大量存在:Al3+、Ba2+、![]() 、H+
、H+
D.0.1 mol·L1NH3·H2O溶液:K+、Fe3+、![]() 、SCN-
、SCN-
【答案】C
【解析】
A.水电离出的H+浓度为1.0×10-13mol·L-1,抑制了水的电离,可能是酸性溶液或者是碱性溶液,![]() 、
、![]() 在酸性溶液中不能大量共存,故A错误;
在酸性溶液中不能大量共存,故A错误;
B.使甲基橙呈红色的溶液是酸性溶液,ClO与氢离子不能大量共存,故B错误;
C.相互之间不反应,可以大量共存,形成的溶液都是无色离子,故C正确;
D.Fe3+与NH3·H2O、SCN-不能大量共存,故D错误;
故选:C。

【题目】实验室可用苯乙酮间接电氧化法合成苯甲酸,原理如图所示:
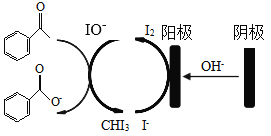
实验步骤如下:
步骤I:电合成:在电解池中加入KI、20mL蒸馏水和20mL的1,4-二氧六环,搅拌至完全溶解,再加入20mL苯乙酮,连接电化学装置,恒定电压下电解7h;
步骤II:清洗分离:反应停止后,将反应液转移至烧瓶,蒸馏除去反应溶剂;用蒸馏水和二氯甲烷洗涤烧瓶,将洗涤液转移至分液漏斗;用二氯甲烷萃取除去质,分离出水相和有机相;
步骤III:制得产品:用浓盐酸酸化水相至pH为1~2,接着加入饱和NaHSO3溶液,振荡、抽滤、干燥,称量得到产品7.8g;
有关物质的数据如下表所示:
物质 | 分子式 | 溶解性 | 沸点(℃) | 密度(g/cm3) | 相对分子质量 |
苯乙酮 | C8H8O | 难溶于水 | 202.3 | 1.03 | 120 |
苯甲酸 | C7H6O2 | 微溶于水 | 249 | 1.27 | 122 |
二氯甲烷 | CH2Cl2 | 不溶于水 | 40 | 1.33 | 85 |
回答下列问题:
(1)步骤I中,阴极的电极反应式为________________________ ,苯乙酮被氧化的离子方程式为_____________________
(2)步骤II蒸馏过程中,需要使用到的玻璃仪器有____________,(填标号)除此之外还需要____________________
(3)步骤II分液过程中,应充分振荡,静置分层后________(填标号)
A.直接将有机相从分液漏斗的上口倒出
B.直接将有机相从分液漏斗的下口放出
C.先将有机相从分液漏斗的下口放出,再将水相从下口放出
D.先将有机相从分液漏斗的下口放出,再将水相从上口倒出
(4)步骤III中,加入浓盐酸的目的是____________________
(5)步骤III中,加入饱和NaHSO3溶液,水相中的颜色明显变浅,说明过量的I2被还原为I-,其离子方程式为_______________________
(6)本实验的产率是______________(保留小数后一位有效数字)
(7)得到的粗苯甲酸可用____________法进行提纯。