题目内容
下列表示氮原子结构的化学用语中,对核外电子运动状态描述正确且能据此确定电子的能级的是
A.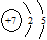 | B.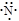 | C.1s22s22p3 | D.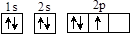 |
C
解析试题分析:A是N原子的电子式,只能看出在原子核外各个电子层上含有的电子数的多少,不能描述核外电子运动状态。错误。B是N原子的电子式,可以得到原子的最外电子层上有5个电子,不能描述核外电子运动状态。错误。C.是N原子的核外电子排布式,不仅知道原子核外有几个电子层,还知道各个电子层上有几个电子亚层,及核外电子运动状态。正确。D是N原子的轨道表示式,但原子核外的电子总是尽可能的成单排列,即在2p的三个轨道上各有一个电子存在,这样的排布使原子的能量最低。错误。
考点:考查关于原子结构的各种化学用语的知识。

X、Y、Z、M、W为短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的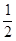 。下列说法正确的是
。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.由X元素形成的单质不一定是原子晶体 |
| C.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
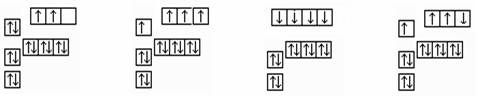
如图表示1~18号元素原子的结构或性质随核电荷数递增的变化。图中纵坐标表示
| A.电子层数 | B.原子半径 | C.最高化合价 | D.最外层电子数 |
类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
| A.SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高 |
| B.钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂 |
| C.Al(OH)3能溶于NaOH溶液,则Be(OH)2能溶于NaOH溶液 |
| D.甲酸甲酯能发生银镜反应,则乙酸甲酯能发生银镜反应 |
六种短周期元素(a、b、c、d、e、f)的原子序数依次增大。其中a与e同主族,b与f同主族,e与f同周期;常温下a、e的单质状态不同;d的核电荷数是b的最外层电子数的2倍;单质f是一种重要的半导体材料。由此可推知
| A.a、c两种元素只能组成化学式为ca3的化合物 |
| B.b、c、d分别与a形成的化合物,沸点由高到低依次为:d>c>b |
| C.原子半径由大到小的顺序是 e>f>b>c>a |
| D.元素的非金属性由强到弱的顺序是 d>c>f>b |
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的阴离子核外电子排布与氦原子相同,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法中正确的是( )
| A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X |
| B.化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键 |
| C.用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 |
| D.X、Z两元素能形成原子个数比为3∶1和4∶2的化合物 |
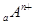 、
、 、
、 、
、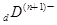 电子层结构相同。关于A、B、C、D四种元素叙述正确的是
电子层结构相同。关于A、B、C、D四种元素叙述正确的是