题目内容
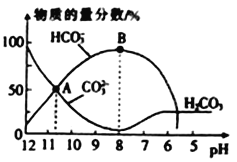
【题目】已知常温下CH3COOH的电离常数K=1.6×10-5,1g4=0.6。该温度下,向20mL0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是
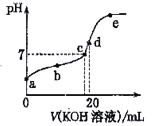
A. 滴定过程中宜选用甲基橙作指示剂
B. a点溶液中c(H+)为1×10-4 mol·L-1
C. a、b、c、d、e四点中水的电离程度最大的是e点
D. d 点时溶质的水解常数为6.25×10-10
【答案】D
【解析】A.滴定终点为醋酸钾溶液,显碱性,应该选用酚酞作指示剂,故A错误;B.25℃时CH3COOH的电离常数K=1.6×10-5,a点为0.01molL-1CH3COOH溶液,设氢离子浓度为x,则c(CH3COO-)≈c(H+)=x,c(CH3COOH)≈0.01molL-1, ![]() =1.6×10-5,解得:x=4.0×10-4mol/L,故B错误;C.根据图像可知,a→e过程中溶液的酸性逐渐减弱,碱性逐渐增强,在d点是恰好生成醋酸钾,醋酸根的水解程度最大,对水的电离的促进程度最大,水的电离程度最大的是d点,故C错误;D. d 点为醋酸钾溶液,溶质的水解常数=
=1.6×10-5,解得:x=4.0×10-4mol/L,故B错误;C.根据图像可知,a→e过程中溶液的酸性逐渐减弱,碱性逐渐增强,在d点是恰好生成醋酸钾,醋酸根的水解程度最大,对水的电离的促进程度最大,水的电离程度最大的是d点,故C错误;D. d 点为醋酸钾溶液,溶质的水解常数=![]() =
=![]() =6.25×10-10,故D正确;故选D。
=6.25×10-10,故D正确;故选D。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目