题目内容
【题目】相对分子质量为M的气态化合物VL(标准状况)溶于mg水中,得到溶液的质量分数为ω%,物质的量浓度cmol/L,密度为ρg/cm3,则下列说法正确的是
A. 相对分子质量M可表示为:![]()
B. 溶液密度ρ可表示为:![]()
C. 溶液的质量分数ω%可表示为:![]()
D. 物质的量浓度C可表示为:![]()
【答案】A
【解析】
A、mg:m(溶质)=(1-ω%):ω%,所以m(溶质)=![]() g,所以
g,所以![]() ×Mg/mol=
×Mg/mol=![]() g,解得M=
g,解得M=![]() ,所以该气体的相对分子质量为
,所以该气体的相对分子质量为![]() ,选项A正确;B、由于c=
,选项A正确;B、由于c=![]() ,所以ρ=
,所以ρ=![]() =
=![]() ,选项B错误; C、溶质的质量为
,选项B错误; C、溶质的质量为![]() ×Mg/mol =
×Mg/mol =![]() g,溶液质量为mg+
g,溶液质量为mg+![]() ×Mg/mol=(m+
×Mg/mol=(m+![]() )g,所以质量分数为
)g,所以质量分数为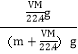 =
=![]() ,选项C错误;D、溶质的物质的量为以
,选项C错误;D、溶质的物质的量为以![]() =
=![]() mol,溶液质量为mg+
mol,溶液质量为mg+![]() ×Mg/mol=(m+
×Mg/mol=(m+![]() )g,所以溶液的体积为
)g,所以溶液的体积为![]() ,所以溶液浓度为
,所以溶液浓度为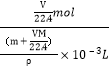 =
=![]() mol/L,选项D错误;答案选A。
mol/L,选项D错误;答案选A。

【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:________________________。
(2)已知在一定温度下,①C(s)+CO2(g)![]() 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)![]() CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。
则K1、K2、K3之间的关系是:_____________,△H3=__________(用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
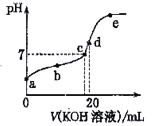
该反应的正反应方向是_________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的平衡转化率为:______________。
(4)在催化剂存在条件下反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如下左图所示;
CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如下左图所示;

对于气相反应,用某组分(B)的平衡分压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应的KP的表达式:KP=____________,提高p[H2O(g)]/p(CO)比,则KP__________(填“变大”、“变小”或“不变”)。实际上,在使用铁镁催化剂的工业流程中,一般采用400℃左右、p[H2O(g)]/p(CO)=3~5。其原因可能是_________________________________。
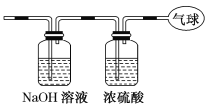
(5)工业上可利用原电池原理除去工业尾气中的CO并利用其电能,反应装置如上右图所示,请写出负极的电极反应式:___________________________________。