题目内容
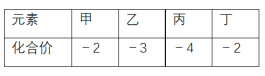
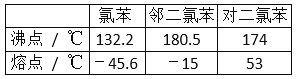
【题目】在一定条件下,苯与氯气在氯化铁催化下连续反应,生成以氯苯、氯化氢为主要产物,邻二氯苯、对二氯苯为次要产物的粗氯代苯混合物。有关物质的沸点、熔点如图,下列说法不正确的是( )
A. 该反应属于取代反应
B. 反应放出的氯化氢可以用水吸收
C. 用蒸馏的方法可将邻二氯苯从有机混合物中首先分离出来
D. 从上述两种二氯苯混合物中,用冷却结晶的方法可将对二氯苯分离出来
【答案】C
【解析】
A.苯与氯气反应生成氯代苯混合物,苯环上H被取代;
B.HCl极易溶于水;
C.由表格数据可知,沸点低的先被蒸馏出;
D.邻二氯苯、对二氯苯的沸点接近,但熔点差异大.
A.苯与氯气反应生成氯代苯混合物,苯环上H被取代,为取代反应,故A正确;
B.HCl极易溶于水,卤代烃不溶于水,则反应放出的氯化氢可以用水吸收,故B正确;
C.由表格数据可知,沸点低的先被蒸馏出,则氯苯从有机混合物中首先分离出来,故C错误;
D.邻二氯苯、对二氯苯的沸点接近,但熔点差异大,则用冷却结晶的方法可将对二氯苯分离出来,故D正确;
故选C。

【题目】Ⅰ.下图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素①~⑧中,除⑧外,原子半径最大的是___________(填元素符号),元素③、⑦所形成的氢化物的稳定性由强到弱的顺序为__________________(用相应氢化物的化学式作答)元素②的氢化物的电子式是____________。
(2)④⑤⑥三种元素的氢氧化物的碱性由强到弱的顺序是________(用相应氢氧化物的化学式作答),元素①~⑧中的最高价氧化物对应的水化物中酸性最强的酸是_______(填化学式)。
Ⅱ.实验室用密度为1.84g/cm3,溶质的质量分数为98%的硫酸,配制980mL物质的量浓度为0.1mol/L的硫酸。供选用的仪器有:①胶头滴管;②药匙;③烧杯;④量筒;⑤托盘天平。请回答下列问题:
(1)配制上述溶液量取浓硫酸时应选用__________量筒(选填序号)
①10mL ②50mL ③100mL;
(2)配制稀硫酸时,上述仪器中还缺少的仪器有____________________________(写仪器名称),不需要使用的有______________(选填序号);
(3)下列操作使所配溶液的物质的量浓度偏低的是___________。
A.用量筒量取的浓硫酸,慢慢地沿着玻璃棒注入盛有20mL蒸馏水的小烧杯,搅拌后,立即转移到容量瓶中,再按正确操作配制溶液。
B.往容量瓶转移溶液时,有少量液体溅出。
C.未洗涤稀释浓硫酸的小烧杯
D.定容时俯视刻度线。
E.容量瓶未干燥即用来配制溶液。
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线。
【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为______________。
(2)第一电离能I1:N__________O(填“>”或“<”),第二电离能I2:O大于N的原因是_________________。
(3)O3的空间构型为__________________;分子中存在大π键,可用符号Π![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H—N、____________________、__________________________(任写两种即可)。
(5)已知:表格中键能和键长数目。
化学键 | 键长/pm | 键能/(kJ·mol-1) |
N-N | 145 | 193 |
N=N | 125 | 418 |
N≡N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正四面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________。
(6)Na2O的晶胞结构如图所示 ,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]
,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]