题目内容
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
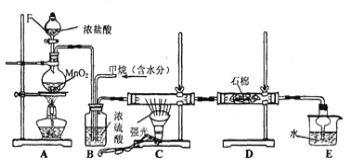
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。

(1)装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55 ℃蒸发结晶;②趁热过滤;③ ;④低于60 ℃干燥,得到成品。
实验Ⅱ. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为 。
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
【答案】(1)防止倒吸 (2)2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 (3)用38-60 ℃的温水洗涤
(4)溶液由蓝色变为无色,且30 s内不变色 (5)![]() % (6)4I-+O2+4H+=2I2+2H2O
% (6)4I-+O2+4H+=2I2+2H2O
【解析】
试题分析:(1)装置④中气体反应,装置内压强降低,因此装置③是安全瓶能防止倒吸;
(2)亚硫酸钠具有还原性,在反应中作还原剂;装置②中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置④反应后的溶液获得NaClO2晶体,故装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥;
(4)碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
(5)令样品中NaClO2的质量分数为a,则:
NaClO2~2I2~4S2O32-
90.5g 4mol
mag c molL-1×V×10-3L×250mL/25mlL
所以90.5g:mag=4mol:c molL-1×V×10-3L×250mL/25mlL
解得a=![]() % ;
% ;
(6)实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘,同时生成水,反应离子方程式为4I-+O2+4H+=2I2+2H2O。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案