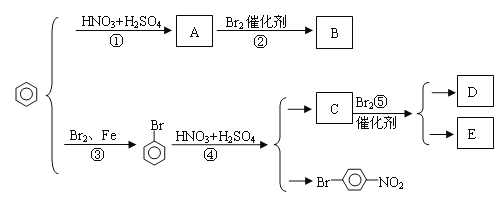
题目内容
【题目】[化学—选修3:物质结构与性质] 化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用。
(1)高温超导材料钇钡铜氧的化学式为YBaCu3O7,其中1/3的Cu以罕见的Cu3+形式存在。Cu在元素周期表中的位置为____ ,基态Cu3+的核外电子排布式为_ _______。
(2)磁性材料在生活和科学技术中应用广泛。研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性。下列物质适合作录音磁带磁粉原料的为____(填选项字母)。
A.V2O5 | B.CrO2 | C.PbO | D.ZnO |
(3)屠呦呦因在抗疟药——青蒿素研究中的杰出贡献,成为首获科学类诺贝尔奖的中国人。青蒿素的结构简式如图l所示,其组成元素的电负性由大到小的顺序为 ;碳原子的杂化方式有____ 。
(4)“可燃冰”因储量大、污染小被视为未来石油的替代能源,由甲烷和水形成的“可燃冰”结构如图2所示。
①“可燃冰”中分子间存在的2种作用力为 。
②H2O的VSEPR模型为 ,比较键角的大小:H2O CH4(填“>”“<”或“=”),原因为 。
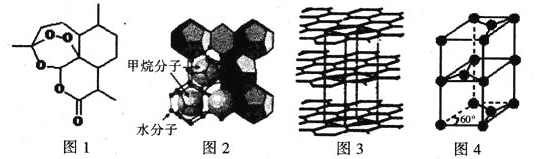
(5)锂离子电池在便携式电子设备以及电动汽车、卫星等领域显示出广阔的应用前景,该电池负极材料为石墨,石墨为层状结构(如图3),其晶胞结构如图4所示,该晶胞中有 个碳原子。已知石墨的层间距为apm,C-C键长为b pm,阿伏伽德罗常数的值为NA,则石墨晶体的密度为 g·cm-3(列出计算式)。
【答案】(1)第四周期第ⅠB族 [Ar] 3d8
(2)B
(3)O>C>H sp2、sp3(共1分,有错或不全均不得分`.)
(4)①氢键、范德华力②四面体形 < 甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小。(1分,答案合理即可得分)
(5)4,![]() 或
或![]() 或
或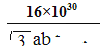
【解析】试题分析:(1)据元素周期表得,铜在周期表中位于:第四周期第ⅠB族;铜是29号元素故Cu3+的核外电子排布式为:[Ar] 3d8。(2)四价Cr核外有未成对电子故有磁性,答案选B。(3)由图1得,组成元素是CHO三种元素,故其电负性由大到小的顺序为:O>C>H;其中碳原子存在双键和单键故为sp2、sp3杂化。(4)①可燃冰中存在水,故有氢键,分子之间存在范德华力;②水分子中价层电子对个数=2+1/2×(6-2×1)=4且含有2个孤电子对,所以其空间构型为四面体结构;甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小,故H20<CH4。(5)中间四个顶点代表的原子被四个相邻的晶胞所共享,这样每个晶胞中只分摊到0.25个原子,一个晶胞中含有碳原子数=0.25*4=1,上层和下层八个顶点各属于八个晶胞每个晶胞只分摊到1/8,一个晶胞中含有碳原子数=1/8/*8=1,体心上一个,上下面上各占半个共1个,故一个晶胞中含有碳原子数4个碳原子;密度=质量/体积=![]() =
=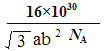 。
。