题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1的NaI溶液:K+、H+、SO42-、NO3- |
| B.0.1 mol·L-1的NaHCO3溶液:K+、Na+、NO3-、Cl- |
| C.0.1 mol·L-1 FeCl3溶液:K+、Na+、ClO-、Cl- |
| D.0.1 mol·L-1的氨水:Cu2+、Na+、SO42-、NO3- |
B
解析试题分析:A、I- 能被酸性条件下的NO3-氧化,错误;C、Fe3+与ClO-双水解而不共存,错误;D、Cu2+与氨水反应形成铜氨络离子而不能大量共存,错误。
考点:考查离子共存知识。

练习册系列答案
相关题目
下列化学反应的离子方程式不正确的是
A.Na2S溶液中加入少量FeCl3溶液:2Fe3++S2- 2Fe2++S↓ 2Fe2++S↓ |
| B.向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应: Ca2++2OH-+2HCO3-  CaCO3↓+2H2O+CO32- CaCO3↓+2H2O+CO32- |
C.向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O SO42-+Cl-+2H+ SO42-+Cl-+2H+ |
D.Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: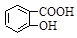 +CO32- +CO32- 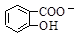 +HCO3- +HCO3- |
下列表示对应化学反应的离子方程式正确的是
| A.Ca(ClO)2溶液中通入少量SO2:Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓ + 2HClO |
| B.NaHSO4溶液与Ba(OH)2溶液混合后呈中性:2H++SO42-+Ba2++2OH-= BaSO4↓+2H2O |
| C.少量CO2通入苯酚钠溶液:2C6H5O-+ CO2 + H2O →2C6H5OH + CO32- |
| D.磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4 + 8H+= Fe2+ + 2Fe3+ + 4H2O |
下列叙述或离子方程式书写正确的是 ( )
| A.将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-=SO42-+Cl-+2H+ |
| B.向含有Fe2O3悬浊液中通入HI气体: Fe2O3 + 6H+ = 2Fe3+ + 3H2O |
C.用惰性电极电解MgCl2溶液:2Cl- + 2H2O  Cl2↑+ H2↑+ 2OH- Cl2↑+ H2↑+ 2OH- |
| D.等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应: |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.H2S溶液中: Br-、Na+ 、SO42-、Hg2+ |
| B.c(H+)=l×l0-13mol/L的溶液中:K+ 、Cl-、SO42-、 C6H5O- |
| C.与铝反应产生大量氢气的溶液中: NO3-、I- 、Al3+、Na+ |
| D.含有0.1mol/L Fe3+的溶液中: CO32-、NH4+、 NO3-、 Na+ |
下列表示对应化学反应的离子方程式正确的是
| A.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2H2O |
| B.二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ |
| C.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O |
| D.碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3·H2O |
某混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH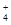 、Ba2+、Cl-、CO32-、SO42-。
、Ba2+、Cl-、CO32-、SO42-。
现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g。根据上述实验事实,以下推测中正确的是
| A.一定不存在Ba2+,可能存在NH4+ |
| B.不可能存在Ba2+、Cl- |
| C.Na+一定存在,且c(Na+)≥0.2 mol/L |
| D.Na+、Cl-可能存在 |
下列离子方程式书写正确的是
| A.将铜屑加入Fe3+溶液中:Fe3++Cu=Fe2++Cu2+ |
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH- NH3↑+H2O NH3↑+H2O |
| C.稀硝酸和过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
| D.KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+ =2H2O+I2 |
配合物在许多方面有着广泛的应用。下列叙述不正确的是
| A.CuSO4溶液呈天蓝色是因为含有[Cu(H2O)4]2+ |
| B.魔术表演中常用一种含硫氰化铁配离子的溶液来代替血液 |
| C.[Ag(NH3)2]+是化学镀银的有效成分 |
| D.除去硝酸银溶液中的Ag+,可向其中逐滴加入氨水 |