题目内容
下列离子方程式书写正确的是
| A.将铜屑加入Fe3+溶液中:Fe3++Cu=Fe2++Cu2+ |
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-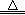 NH3↑+H2O NH3↑+H2O |
| C.稀硝酸和过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
| D.KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+ =2H2O+I2 |
D
解析试题分析:铁元素由+3降为+2价,铜元素由0升高为+2价,则铁元素化合价降低数为1,铜元素化合价升高数为2,因此得失电子不守恒;等号左边物质带3个正电荷,右边物质带4个正电荷,因此左右电荷不守恒,所以该反应没有配平,铜屑加入铁盐溶液中的反应为2Fe3++Cu=2Fe2++Cu2+,故A错误;由于KOH过量,不仅铵根离子与氢氧根离子能完全反应,而且碳酸氢根离子与氢氧根离子也能完全反应,不能漏写离子反应,则碳酸氢铵溶液与氢氧化钾溶液共热的反应为NH4++HCO3-+2OH-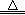 NH3↑+CO32-+2H2O,故B错误;铁离子具有氧化性,铁具有还原性,则铁离子与过量的单质铁能继续发生氧化还原反应,生成亚铁离子,不能违反这个客观反应事实,也不能违反电荷守恒原理,所以稀硝酸和过量的铁屑反应为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故C错误;碘离子具有还原性,过氧化氢在酸性条件下具有氧化性,二者能发生氧化还原反应,生成单质碘和水,该反应式符合客观反应事实,也符合电子守恒、电荷守恒、原子守恒,故D正确。
NH3↑+CO32-+2H2O,故B错误;铁离子具有氧化性,铁具有还原性,则铁离子与过量的单质铁能继续发生氧化还原反应,生成亚铁离子,不能违反这个客观反应事实,也不能违反电荷守恒原理,所以稀硝酸和过量的铁屑反应为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故C错误;碘离子具有还原性,过氧化氢在酸性条件下具有氧化性,二者能发生氧化还原反应,生成单质碘和水,该反应式符合客观反应事实,也符合电子守恒、电荷守恒、原子守恒,故D正确。
考点:考查离子方程式,涉及氧化还原反应、复分解反应、过量反应物与生成物继续反应等。

练习册系列答案
相关题目
在指定条件下,下列各组离子可能大量共存的是
A.无色澄清透明溶液中: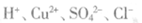 |
B.与铝反应放出H2的溶液中: |
C.滴加酚酞显红色有溶液中: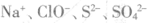 |
D.由水电离的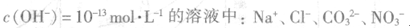 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1的NaI溶液:K+、H+、SO42-、NO3- |
| B.0.1 mol·L-1的NaHCO3溶液:K+、Na+、NO3-、Cl- |
| C.0.1 mol·L-1 FeCl3溶液:K+、Na+、ClO-、Cl- |
| D.0.1 mol·L-1的氨水:Cu2+、Na+、SO42-、NO3- |
下列离子方程式正确的是
| A.氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| B.稀硝酸中加入过量铁粉: Fe + 4H++ NO3-=Fe3++ NO↑ + 2H2O |
| C.用NaOH溶液吸收废气中氮氧化物:NO+NO2+OH-=NO2-+H2O |
D.苯酚钠溶液中通入少量CO2: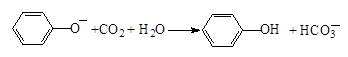 |
水溶液中能大量共存的离子组是
| A.Fe3+、Na+、SO42-、Cl- |
| B.H+、Fe2+、Cl-、NO3- |
| C.Ag+、Na+、CO32-、NO3- |
| D.Al3+、K+、Cl-、AlO2- |
下列离子方程式正确的是
| A.氢氧化镁与稀盐酸反应:H+ + OH-=H2O |
| B.AlCl3溶液中加入少量氨水:Al3++3OH-=Al(OH)3↓ |
| C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| D.次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
下列溶液中,各组离子一定能大量共存的是
| A.能使石蕊试液呈蓝色的溶液:Na+、I-、Cl-、NO3- |
| B.含大量Fe3+的溶液:NH4+、Na+、Cl-、SCN- |
| C.能与Al反应生成H2的溶液:Ca2+、NH4+、HCO3-、Cl- |
| D.水电离出的c(H+)=1×10-14mol/L的溶液:K+、AlO2-、Br-、Cl- |
在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是
| A.Na+、K+、OH-、Cl- | B.Na+、Cu2+、SO42-、NO3- |
| C.Mg2+、Na+、SO42-、Cl- | D.K+、Na+、NO3-、CO32- |
下列离子方程式书写正确的是
| A.硫氢化钠的水解:HS-+H2O === S2-+H3O+ |
| B.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=== Fe3++3H2O |
| C.钢铁发生吸氧腐蚀的负极反应式:O2+4e-+2H2O === 4OH- |
| D.碳酸氢铵溶液中滴入少量烧碱溶液:HCO3-+OH-=== CO32-+H2O |