题目内容
某混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH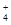 、Ba2+、Cl-、CO32-、SO42-。
、Ba2+、Cl-、CO32-、SO42-。
现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g。根据上述实验事实,以下推测中正确的是
| A.一定不存在Ba2+,可能存在NH4+ |
| B.不可能存在Ba2+、Cl- |
| C.Na+一定存在,且c(Na+)≥0.2 mol/L |
| D.Na+、Cl-可能存在 |
C
解析试题分析:由第一份加足量NaOH溶液,加热,收集到气体1.36g可断定溶液中一定含有氨根离子;由第二份溶液的实验,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,可得溶液中一定存在碳酸根离子和硫酸根离子且一定不存在钡离子;根据题干所给数据计算分析判断其他离子的存在;①第一份加足量NaOH溶液,加热,收集到气体,则气体必为氨气,物质的量为0.08mol;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g。则前者沉淀为硫酸钡和碳酸钡,硫酸钡物质的量为: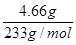 =0.02mol;碳酸根物质的量:
=0.02mol;碳酸根物质的量: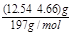 =0.04mol;负电荷总物质的量=0.02mol×2+0.04mol×2=0.12mol;铵根离子所带正电荷=0.08mol×1=0.08mol;所以应该还有阳离子,而钡离子已经确定不含,所以一定含有钠离子。依据电荷守恒,[H+]+[Na+]+[NH4+]=2[CO32-]+2[SO42-]+[OH-],依据溶液中的离子水解可知若[H+]<[OH-],[Na+]+[NH4+]>2[CO32-]+2[SO42-],得到[Na+]>2[CO32-]+2[SO42-]-[NH4+]>2×0.2+2×0.1-0.4>0.2mol/L,若溶液中的离子水解相当,则[Na+]=0.2mol/L;由于铵根离子水解程度小于碳酸根离子的水解程度,所以溶液不能显酸性;所以一定含钠离子,且c(Na+)≥0.2mol/L;
=0.04mol;负电荷总物质的量=0.02mol×2+0.04mol×2=0.12mol;铵根离子所带正电荷=0.08mol×1=0.08mol;所以应该还有阳离子,而钡离子已经确定不含,所以一定含有钠离子。依据电荷守恒,[H+]+[Na+]+[NH4+]=2[CO32-]+2[SO42-]+[OH-],依据溶液中的离子水解可知若[H+]<[OH-],[Na+]+[NH4+]>2[CO32-]+2[SO42-],得到[Na+]>2[CO32-]+2[SO42-]-[NH4+]>2×0.2+2×0.1-0.4>0.2mol/L,若溶液中的离子水解相当,则[Na+]=0.2mol/L;由于铵根离子水解程度小于碳酸根离子的水解程度,所以溶液不能显酸性;所以一定含钠离子,且c(Na+)≥0.2mol/L;
综上所述,溶液中一定含有Na+、NH4+、CO32-、SO42-离子,一定不含Ba2+离子,可能含有Cl-离子;
故选C.
考点:掌握溶液中离子间的共存关系对于解决此类问题有很大帮助:溶液中的离子不能形成气体、水和沉淀时,离子可以共存.

下列相关离子方程式的书写正确的是( )
A.硫化亚铁溶于适量稀硝酸中: → →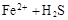 ↑ ↑ |
B.向水中通入少量氯气:Cl2 + H2O 2H+ + Cl﹣+ ClO﹣ 2H+ + Cl﹣+ ClO﹣ |
C.碳酸氢钠溶液中加入过量Ba(OH)2溶液: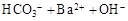 → →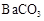 ↓ ↓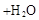 |
D.硫酸溶液中加入过量Ba(OH)2溶液: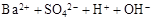 → →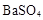 ↓ ↓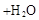 |
下列离子方程式书写正确的是
| A.以石墨作电极电解CuCl2溶液:2Cl-+2H2O="=" 2OH-+Cl2↑十H2↑ |
| B.FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+==2Fe3++2H2O |
| C.铜跟浓硝酸反应:Cu+4HNO3(浓)==Cu2++2NO3-+2NO↑+2H2O |
| D.NaHSO4溶液与足量Ba(OH)2溶液混合: 2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1的NaI溶液:K+、H+、SO42-、NO3- |
| B.0.1 mol·L-1的NaHCO3溶液:K+、Na+、NO3-、Cl- |
| C.0.1 mol·L-1 FeCl3溶液:K+、Na+、ClO-、Cl- |
| D.0.1 mol·L-1的氨水:Cu2+、Na+、SO42-、NO3- |
下列表示对应化学反应的离子方程式正确的是
| A.向NaHS溶液中通入Cl2:S2-+Cl2=S↓+2Cl- |
| B.向NaNO2溶液中滴加酸性KMnO4溶液:5NO2-+2MnO4-+3H2O=5NO3-+2Mn2++6OH- |
| C.向NH4HSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O |
| D.向偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
下列离子方程式正确的是
| A.氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| B.稀硝酸中加入过量铁粉: Fe + 4H++ NO3-=Fe3++ NO↑ + 2H2O |
| C.用NaOH溶液吸收废气中氮氧化物:NO+NO2+OH-=NO2-+H2O |
D.苯酚钠溶液中通入少量CO2: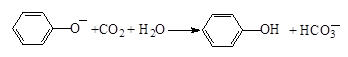 |
水溶液中能大量共存的离子组是
| A.Fe3+、Na+、SO42-、Cl- |
| B.H+、Fe2+、Cl-、NO3- |
| C.Ag+、Na+、CO32-、NO3- |
| D.Al3+、K+、Cl-、AlO2- |
下列溶液中,各组离子一定能大量共存的是
| A.能使石蕊试液呈蓝色的溶液:Na+、I-、Cl-、NO3- |
| B.含大量Fe3+的溶液:NH4+、Na+、Cl-、SCN- |
| C.能与Al反应生成H2的溶液:Ca2+、NH4+、HCO3-、Cl- |
| D.水电离出的c(H+)=1×10-14mol/L的溶液:K+、AlO2-、Br-、Cl- |
一定能在下列溶液中共存的离子组是( )
| A.加入铝粉有气体放出的溶液中:Na+、NH4+、NO3-、Cl- |
| B.加入NaOH溶液后加热既有气体放出又有沉淀生成的溶液中:Mg2+、NH4+、SO42-、Na+ |
| C.pH=0.3的溶液中:Na+、Al3+、SO42-、CO32- |
| D.存在较多H+、SO42-、NO3-的溶液中:Al3+、CH3COO-、Cl-、K+ |