题目内容
9.把CO2和NO的混合气体VL缓缓通过足量的Na2O2固体,充分反应后,测得剩余气体体积大约只有原来的一半,则混合气体中CO2和NO的体积比不可能是( )| A. | 2:1 | B. | 3:2 | C. | 3:4 | D. | 5:4 |
分析 发生反应有:①2Na2O2+2CO2═2Na2CO3+O2,②2NO+O2═2NO2,NO与氧气反应存在着三种可能性,一种情况是恰好反应,一种情况是NO过量,另一种情况可能是O2过量,据此讨论计算.
解答 解:发生反应有:①2Na2O2+2CO2═2Na2CO3+O2,②2NO+O2═2NO2,
假设参加反应的CO2为x L,NO为y L,则x+y=V,反应后剩余气体体积为:$\frac{V}{2}$=$\frac{1}{2}$(x+y),
2CO2+2Na2O2=2Na2CO3+O2…①
2L 1L
xL $\frac{x}{2}$L
2NO+O2=2NO2 …②
2L 1L 2L
yL $\frac{x}{2}$L
(1)当反应②恰好反应时,即当y=x时,生成的NO2的体积为yL,符合题意;
(2)当y>x时,NO有过量,O2反应完,此时反应掉的NO为xL,则剩余的NO为(yL-xL),生成的NO2气体为xL,因此,反应最后得到的混合气体为NO和NO2,其体积和为:(yL-xL)+xL=yL,由于y>x,则剩余气体体积大于原来的一半,不符合题意;
(3)当y<x时,NO不足,O2过量,此时反应掉的O2为$\frac{y}{2}$L,剩余的O2为($\frac{x}{2}$L-$\frac{y}{2}$L),生成的NO2气体为yL;因此,反应最后得到的混合气体为O2和NO2,其体积和为:($\frac{x}{2}$L-$\frac{y}{2}$L)+yL=$\frac{x}{2}$L+$\frac{y}{2}$L=$\frac{1}{2}$(x+y)L,这与题意“测得剩余气体体积大约只有原来的一半”符合,这表明如果y<x,这种情况都能符合题意,所以选项A、B、D符合,C不符合,
故选C.
点评 本题考查混合物反应的有关计算,属于讨论型计算,题目难度较大,侧重对学生综合能力的考查,注意明确讨论法在化学计算中的应用.

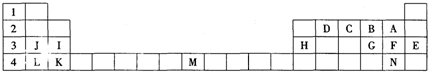
| A. | 四种元素的原子半径:A<B<D<C | |
| B. | D元素处于元素周期表中第3周期第ⅥA族 | |
| C. | B、D的最高价氧化物中,B、D与氧原子之间均为双键 | |
| D. | 一定条件下,D单质能置换出B单质,C单质能置换出A单质 |
| A. | 滴加甲基橙试剂呈红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | pH为11的溶液:S2-、SO32-、S2O32-、Na+ | |
| C. | 水电离出来的c (OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 无色透明的溶液:K+、SiO32-、NO3-、Al3+ |

| A. | 加压 | B. | 增加O2的浓度 | ||
| C. | 使用催化剂 | D. | 同时增大SO3和O2的浓度 |
| A. | (n+0.2)mol | B. | (n+0.4)mol | C. | 0.28 mol | D. | 0.31 mol |
 .
.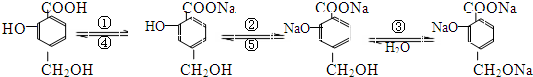
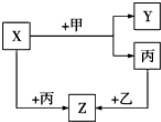
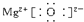 ;
;
