题目内容
【题目】近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。下图是以Cu作为催化剂CO2转化为甲酸的反应过程,有关说法不正确的是
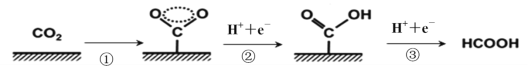
A.过程①说明在催化剂作用下,O-C-O之间形成了一种特殊的化学键
B.过程②形成O-H键的过程放出了能量
C.反应过程中微粒间的碰撞均为有效碰撞
D.每1 mol CO2完全转化为甲酸需得2 mol e-
【答案】C
【解析】
A.据图可知过程①中催化剂作用下,碳氧双键断裂,O-C-O之间形成了一种特殊的化学键,故A正确;
B.化学键的形成过程释放能量,故B正确;
C.活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞,故C错误;
D.二氧化碳转化为甲酸时,碳元素由+4价变为+2价,故1 mol CO2完全转化为甲酸需得2 mole-,故D正确;
故答案为C。

【题目】在3个体积均为2.0 L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
I | 977 | 0.28 | 0.56 | 0 | 0.4 |
II | 977 | 0.56 | 0.56 | 0 | x |
III | 1250 | 0 | 0 | 0.56 | y |
A.977K,该反应的化学平衡常数值为2
B.达到平衡时,向容器I中增加C的量,平衡正向移动
C.达到平衡时,容器Ⅰ中CO2的转化率比容器Ⅱ中的大
D.达到平衡时,容器Ⅲ中的CO的转化率大于28.6%
【题目】研究氮及其化合物的性质在人类进步过程中具有极为重要的意义
(1)研究表明,CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。由图可知总反应的化学反应速率由反应____(填“①”或“②”)决定。

(2)工业生产可以用NH3(g)与CO2(g)经两步可逆反应生成尿素,两步反应的能量变化示意图如下:
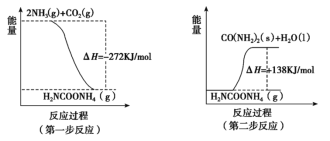
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为____________________。
(3)基元反应是指反应物直接转化为产物的反应。飞秒激光为代表的分子动力学可测得过程中出现的物质的光谱从而研究反应的机理,反应级数是速率方程中浓度项的幂次之和,用n表示。反应级数越大表示浓度对反应速率影响越大。已知:基元反应N2O5═N2O4+![]() O2 v═Kc(N2O5)是一级反应;则基元反应NO2+CO=CO2+NO v=Kc(NO2)c(CO)此反应为__________级反应。(两个方程涉及的物质均为气态)若v的单位为mol/(L·S),用n表示反应级数,则化学反应速率常数K的单位通式为_______________。
O2 v═Kc(N2O5)是一级反应;则基元反应NO2+CO=CO2+NO v=Kc(NO2)c(CO)此反应为__________级反应。(两个方程涉及的物质均为气态)若v的单位为mol/(L·S),用n表示反应级数,则化学反应速率常数K的单位通式为_______________。
(4)已知反应:2NO(g)+2H2(g)N2(g)+2H2O(g)在1L密闭容器中进行,该反应达到平衡过程测得下表数据。
实验序号 | 温度℃ | 初始NO浓度(mol·L-1) | 初始H2浓度(mol·L-1) | NO的平衡转化率 |
1 | 110 | 1.2 | 1.2 | a |
2 | 110 | 1.0 | 1.0 | 50% |
3 | 100 | 1.0 | 1.0 | b |
①在110 ℃时,此反应的化学平衡常数为________。
②在实验2的平衡体系中再加入1.0mol NO和
③实验1中,NO的转化率a________50%(填“>”、“=”或“<”)。实验3中,b的值________(填字母序号)。
A.等于50% B.大于50%
C.小于50% D.由本题所给资料无法判断
(5)一种直接肼燃料电池的结构如图所示,回答下列问题
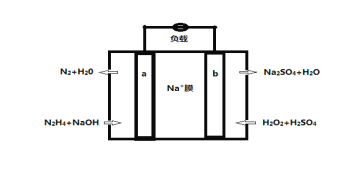
①b为电池的_________极
②负极的电极反应方程式为_________________________________